Date : 20151102
Dossier : T ‑1156‑12
Référence : 2015 CF 1156
[TRADUCTION FRANÇAISE CERTIFIÉE, NON RÉVISÉE]
Ottawa (Ontario), le 2 novembre 2015
En présence de monsieur le juge Annis
|
ENTRE : |
|
GILEAD SCIENCES, INC ET GILEAD SCIENCES CANADA, INC |
|
demanderesses (défenderesses reconventionnelles) |
|
et |
|
IDENIX PHARMACEUTICALS, INC, UNIVERSITA DEGLI STUDI DI CAGLIARI, L’UNIVERSITÉ MONTPELLIER II ET LE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE
|
|
défendeurs
|
|
ET ENTRE :
|
|
IDENIX PHARMACEUTICALS, INC,
|
|
demanderesse reconventionnelle |
|
et
|
|
GILEAD PHARMASSET LLC, GILEAD SCIENCES, INC ET GILEAD SCIENCES CANADA, INC
|
|
défenderesses reconventionnelles et |
|
UNIVERSITA DEGLI STUDI DI CAGLIARI, L’UNIVERSITÉ MONTPELLIER II ET LE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE
|
|
tiers dans la demande reconventionnelle |
VERSION PUBLIQUE DU JUGEMENT ET DES MOTIFS
(Version confidentielle du jugement et des motifs publiée le 9 octobre 2015)
I. Introduction
[1] Gilead Sciences, Inc et Gilead Sciences Canada, Inc (collectivement désignées avec la défenderesse reconventionnelle Gilead Pharmasset LLC comme (Gilead)) sollicitent une déclaration portant que le brevet canadien no 2 490 191 (le brevet 191) est invalide. Elles ont présenté la demande à titre d’intéressés au titre du paragraphe 60(1) de la Loi sur les brevets, LRC 1985, c P‑4, et ses modifications, article 27 (la Loi).
[2] La défenderesse Idenix Pharmaceuticals Inc (Idenix) et les autres défenderesses dans l’action principale sont les titulaires du brevet 191.
[3] Gilead Sciences, Inc est titulaire, par l’entremise de sa filiale Gilead Pharmasset LLC, du brevet canadien 2 527 657 (le brevet 657) déposé le 21 avril 2004 et délivré le 14 juin 2011. Le brevet 657 renferme des revendications visant un nouveau composé, le « sofosbuvir », pour le traitement des infections par le virus de l’hépatite C (VHC).
[4] Gilead prétend être un intéressé ayant des motifs raisonnables de croire que la fabrication, l’utilisation ou la vente du sofosbuvir seront contestées par les défendeurs pour contrefaçon du brevet 191. Cette hypothèse s’est avérée exacte, comme en témoigne la demande reconventionnelle présentée en l’espèce par Idenix.
[5] Le 21 mai 2013 ou vers cette date, Gilead Sciences Canada, Inc a déposé une présentation de drogue nouvelle à l’égard du sofosbuvir, dont la vente au Canada a été approuvée par la délivrance d’un avis de conformité le 13 décembre 2013. Gilead Sciences Canada, Inc vend à présent le sofosbuvir au Canada sous la marque SOVALDI.
[6] SOVALDI est un médicament « révolutionnaire » et représente une avancée importante dans le traitement des infections par le VHC, qui toucheraient plus de 2,2 % de la population mondiale. Il s’agit d’un traitement par voie orale très efficace entraînant peu d’effets secondaires comparativement à d’autres traitements.
[7] Gilead cherche à faire invalider le brevet 191 pour cause de divulgation insuffisante, d’absence d’utilité démontrée et de prédiction valable, et de portée excessive; elle avance qu’Idenix revendique un nombre immense de composés ainsi que leur utilisation, sans divulgation suffisante ni utilité démontrée sur la base du mémoire descriptif du brevet 191, ou des connaissances générales courantes à la date pertinente. Idenix a déposé sa demande de brevet avant d’avoir fabriqué ou mis à l’essai les composés relevant du brevet 191, bien qu’elle y ait consacré plus de dix-huit mois de travail.
[8] Inversement, Idenix prétend être l’inventrice d’un nouvel inhibiteur nucléosidique qui confère au sofosbuvir son activité antivirale. Cette prétention repose en partie sur l’affirmation selon laquelle le nouveau nucléoside serait un analogue de l’une de ses inventions antérieures.
[9] Idenix nie que ses inventeurs n’aient pas valablement prédit l’utilité du nouveau nucléoside dans le sofosbuvir. Elle fait observer que ce nucléoside ne diffère que par un substituant, aux caractéristiques stéréochimiques semblables, du nucléoside divulgué dans son invention antérieure et dont l’activité antivirale est démontrée.
[10] Idenix nie également que le brevet 191 n’indique pas comment fabriquer le nouveau nucléoside. Elle prétend que la synthèse de ce composé n’a rien de nouveau. Un chimiste moyennement versé dans l’art pourrait l’avoir fabriqué à l’aide de la description du brevet 191 et en s’appuyant sur les connaissances générales courantes et des essais courants. Elle soutient que l’inventeur nommé du brevet 657 a synthétisé le nouveau composé sans guère de difficultés, alors que son propre chimiste affecté à cette même tâche a pu lui aussi fabriquer le composé, mais sans le savoir, car il ne s’est pas conduit comme un chimiste versé dans la découverte de médicaments, mais plutôt comme un chimiste de procédés.
[11] Idenix fait valoir en demande reconventionnelle que le nouveau nucléoside du sofosbuvir était antériorisé par le brevet 191. Elle sollicite une déclaration portant que le brevet 657 est invalide et que Gilead a contrefait certaines des revendications de son brevet, ainsi que d’autres mesures de réparation telles qu’une injonction permanente, des dommages-intérêts, etc. Aucun des produits d’Idenix, qu’il soit commercialisé ou en attente d’une autorisation de Santé Canada, ne relève du brevet 191.
[12] Idenix fait valoir subsidiairement que, dans la mesure où elle ne bénéficie pas de la priorité à l’égard d’une invention valide, le brevet 657 est invalide aux termes de l’article 53 de la Loi parce qu’il omet délibérément de nommer Lieven Stuyver comme inventeur, une fausse déclaration qui a été faite selon elle volontairement pour induire en erreur.
[13] Après avoir attentivement examiné la preuve et les observations des parties, j’accueille la demande de Gilead pour les motifs qui suivent. Je déclare le brevet 191 invalide et rejette la demande reconventionnelle d’Idenix dans sa totalité.
II. Le contexte factuel
A. Idenix et ses brevets
[14] Idenix est une société pharmaceutique fondée à la fin des années 1990; elle se consacrait à la découverte, à la mise au point et à la commercialisation de traitements novateurs visant des besoins médicaux non comblés.
[15] Idenix était liée par des ententes de collaboration avec l’Universita Degli Studi Di Cagliari (Cagliari), l’Université Montpellier II (Montpellier) et le Centre national de la recherche scientifique (le CNRS). Plus particulièrement, elle a fondé avec Montpellier et le CNRS un laboratoire collaboratif de chimie situé à Montpellier, en France, et supervisé par MM. Gilles Gosselin (un employé du CNRS) et Richard Storer, le directeur général de la division de chimie chez Idenix.
[16] Idenix a également fondé avec Cagliari un laboratoire collaboratif d’essais biologiques situé à Cagliari, en Italie, et supervisé par le professeur Paolo La Colla de Cagliari.
[17] Le 29 novembre 2001, le brevet WO 01/90121 (le brevet américain 121) a été publié. Il divulguait les structures nucléosidiques D-ribose 2’-méthyl (haut), 2’-hydroxyl (bas) (ci‑après appelées « 2’‑C‑Me/OH ») et leurs dérivés relativement à l’activité contre le VHC. Le 6 décembre 2001, le brevet WO 01/92282 (le brevet américain 282) a lui aussi été publié, divulguant les structures nucléosidiques 2’‑C‑Me/OH relativement à l’activité contre les flavivirus et les pestivirus. Ce sont là les composés précurseurs qui ont mené à la nouvelle invention revendiquée, laquelle vise les structures nucléosidiques D-ribose 2’-méthyl (haut) et 2’-fluor (bas) (ci-après appelées « 2’‑C‑Me/F ») et leurs dérivés.
[18] Le 28 juin 2002, Idenix a déposé la demande de brevet américain 60/392 350 (la demande de brevet américain 350) et la demande de brevet américain 60/392 351 (la demande de brevet américain 351), toutes deux citées en référence dans le brevet 191. La demande de brevet américain 350 renfermait, parmi les nombreux composés revendiqués, les composés 2’‑C‑Me/F. En revanche, la demande de brevet américain 351 ne mentionnait aucun composé 2’‑C‑Me/F. Idenix n’invoque plus la demande de brevet américain 351 en tant que demande de priorité pour le brevet 191.
[19] Le 31 mars 2003, on a annoncé que Novartis devait faire l’acquisition d’une participation majoritaire dans Idenix, y compris le droit de mettre conjointement au point son nucléoside candidat NM283, un nucléoside 2’‑C‑Me/OH, pour le traitement des infections par le VHC.
[20] Le 28 avril 2003, Idenix a déposé la demande de brevet américain 60/466 194 (la demande de brevet américain 194), et le 14 mai suivant, la demande de brevet américain 60/470 949 (la demande de brevet américain 949). Il s’agit dans les deux cas de demandes de priorité se rapportant au brevet 191.
[21] Le 27 juin 2003, Idenix a déposé une demande de brevet au titre du Traité de coopération en matière de brevets (PCT) relativement à son brevet canadien 191, dans laquelle elle nommait les établissements d’enseignement comme cotitulaires du brevet. Elle revendiquait plusieurs grands genres de nucléosides prétendument analogues du nucléoside 2’‑C‑Me/OH. Toutefois, de ses 49 revendications, 32 portaient sur des composés 2’‑C‑Me/F. La demande était fondée sur les documents de priorité suivants : la demande de brevet américain 350, la demande de brevet américain 351 (qui n’est plus invoquée), la demande de brevet américain 194 et la demande de brevet américain 949.
[22] Le 22 septembre 2008 ou vers cette date, l’Office de la propriété intellectuelle du Canada (l’OPIC) a publié une demande dans laquelle il s’opposait à la demande de brevet 191, notamment en raison d’une absence d’unité de l’invention. En ce qui concerne les divers genres revendiqués par Idenix, l’examinateur a relevé quinze catégories différentes de composés et a demandé à Idenix de limiter les revendications de la demande de brevet à une seule catégorie.
[23] Le 23 mars 2009, Idenix a présenté à l’OPIC les revendications modifiées. Elle avait retranché 17 de ses revendications et se limitait maintenant à une catégorie de composés de formule IX faisant l’objet de 32 revendications relatives au genre 2’‑C‑Me/F. Ce sont là les revendications du brevet 191 telles qu’elles ont été présentées le 3 août 2010, et elles sont similaires aux revendications des composés visés par le brevet 657 de Gilead.
[24] Lorsqu’elle a modifié ses revendications, Idenix n’a pas supprimé l’information détaillée relative aux nucléosides 2’‑C‑Me/OH, qui ne s’applique plus aux nucléosides 2’‑C‑Me/F. C’est la raison pour laquelle le brevet 191 tel qu’il est publié prête fortement à confusion. Ajoutons que ce brevet ne divulgue aucune information sur l’étape de fluoration nécessaire à la création du nucléoside 2’‑C‑Me/F, étant donné que Idenix n’a jamais réussi à synthétiser ce composé, à sa connaissance du moins, avant le dépôt de sa demande.
[25] Durant le présent litige, Idenix a modifié sa défense [traduction] « seulement en ce qui concerne le Canada et afin de simplifier les questions à trancher dans la présente instance au Canada, sans que cela constitue un aveu », et déclaré [traduction] « [qu’elle] ne défendra ni ne fera valoir l’allégation de contrefaçon à l’égard de la revendication 1 du brevet 191 ». L’effet de cette modification est un point de désaccord dans le présent litige.
B. La mise au point initiale des composés 2’‑C‑Me/OH par Idenix
[26] Jusque vers la fin de 2004, l’établissement de Montpellier s’est chargé de tous les travaux d’Idenix en chimie de découverte, et l’établissement de Cagliari a quant à lui effectué la plupart des essais biologiques (criblage viral). À partir de 2004, les installations d’Idenix à Cambridge, au Massachusetts, ont aussi procédé à des travaux en chimie des procédés et en biologie du développement.
[27] Vers la fin des années 1960, des scientifiques ont mis au point une classe de nucléosides 2’‑C‑Me/OH. Au début des années 2000, Idenix a découvert qu’un certain nombre d’analogues nucléosidiques connus de structure 2’‑C‑Me/OH avaient une activité in vitro (en laboratoire) contre certains virus de la famille des Flaviviridae. La société a déposé les demandes de brevet américain 121 et 282 relativement à ces composés. L’un des composés (appelé NM283) était un promédicament d’un analogue nucléosidique doté d’un cycle glucidique 2’‑C‑Me/OH et d’une base cytosine.
[28] Idenix (alors Novirio) a tenu une rencontre de chimie à Maui en décembre 2001. M. Gosselin, le professeur La Colla et MM. Sommadossi, Standring et Storer étaient présents avec les membres de l’équipe de chimistes spécialisés dans la découverte de médicaments. Entre autres sujets traités à cette occasion, les chimistes d’Idenix ont parlé d’un certain nombre d’analogues nucléosidiques des composés 2’‑C‑Me/OH qu’ils tenteraient de synthétiser, notamment le nucléoside 2’‑C‑Me/F.
[29] Le 28 mars 2002, Idenix a confié les travaux de synthèse des nucléosides 2’‑C‑Me/F à M. Jean-François Griffon, chimiste de Montpellier ayant déjà une certaine expérience de la fluoration des nucléosides. Ce chimiste et son équipe, dont Mmes Audrey Chappe et Élodie Pécheux, ont tenté sans succès pendant deux ans de fabriquer des nucléosides 2’‑C‑Me/F.
[30] M. Alistair Stewart et Mme Jingyang Wang, chimistes d’Idenix à Cambridge, au Massachusetts, ont continué à travailler à la synthèse des composés 2’‑C‑Me/F à la fin de 2004 et au début de 2005. Ils disent avoir eu du succès en janvier 2005 ou vers ce mois à un moment où Idenix avait été informée par un ex‑employé de Pharmasset que cette société avait réussi à synthétiser le composé 2’‑C‑Me/F. Idenix a clairement réussi à synthétiser le nucléoside 2’‑C‑Me/F en mars 2005. Elle n’avait pas fait l’essai d’un tel nucléoside avant ce mois, soit après la date de publication du brevet 657 de Gilead.
[31] Idenix soutient que M. Griffon est responsable de l’incapacité de la société à démontrer qu’elle avait réussi à synthétiser le composé 2’‑C‑Me/F. Elle prétend que, à maints égards, M. Griffon n’a pas satisfait aux normes applicables à un chimiste versé dans la découverte de médicaments.
[32] Idenix allègue que M. Griffon a réussi sans le savoir à synthétiser un nucléoside 2’‑C‑Me/F. Elle fait valoir qu’Albany Molecular Research Inc (AMRI) a synthétisé la molécule lors d’essais effectués en 2014 à l’aide du même composé intermédiaire, le réactif de fluoration Deoxo-Fluor®, et dans les mêmes conditions que M. Griffon dans ses expériences de février 2003.
[33] Elle soutient que, comme M. Griffon n’a pas caractérisé les produits de la réaction, il n’a pas constaté le succès de ses expériences. Elle ajoute que, comme l’intéressé a affirmé à tort à ses supérieurs qu’un seul nouveau composé s’était formé pendant ses travaux – il ne s’agissait pas du composé visé –, elle n’a pas adopté la méthode la plus évidente, et la seule connue, permettant de synthétiser le nucléoside 2’‑C‑Me/F.
C. Les parties Gilead et leurs brevets
[34] Gilead Sciences Inc est une société biopharmaceutique américaine qui se consacre à la découverte, à la mise au point et à la commercialisation de traitements novateurs visant des besoins médicaux non comblés.
[35] Gilead Sciences Canada, Inc (Gilead Canada) est une filiale en propriété exclusive de Gilead Sciences Inc. Gilead Canada vend au Canada des produits pharmaceutiques aux fins du traitement de maladies telles que l’infection par le VIH, la fibrose kystique et l’hépatite.
[36] Pharmasset Inc, qui a changé de nom et de pays d’origine, était une petite société biopharmaceutique fondée à la fin des années 1990. Elle se consacrait à la découverte et à la mise au point de nouveaux composés destinés au traitement du VIH et des infections par le virus de l’hépatite B (VHB) et le VHC.
[37] Le 30 mai 2003, Pharmasset a déposé la demande de brevet américain provisoire 60/474 368 (la demande de brevet américain 368) visant un composé 2’‑C‑Me/F, demande étayée par des essais sur réplicon démontrant une activité antivirale.
[38] Le 21 avril 2004, Pharmasset a déposé la demande PCT W0 2005/003147 revendiquant la priorité sur la demande de brevet américain 368. La demande PCT a été publiée le 13 janvier 2005 (W0 Clark). La demande de brevet américain 368 et la demande PCT de Pharmasset décrivent entre autres la synthèse d’un composé 2’‑C‑Me/F à base cytosine et l’activité de ce composé contre le VHC dans un essai sur réplicon. Cette synthèse a fait l’objet d’un article de Clark et al., « Design, Synthesis and Antiviral Activity of 2’-Deoxy-2’-fluoro-2’-C-methylcytidine, a Potent Inhibitor of Hepatitis C Virus Replication », J. Med. Chem., 48;5504‑5508 (2005) (l’article de Clark).
[39] Le 14 juin 2011, après des tests et des essais approfondis, le brevet canadien 657 a été délivré.
[40] En novembre 2011, Gilead Sciences Inc a acheté Pharmasset. À la suite de cette acquisition, Pharmasset est devenue Gilead Pharmasset LLC. Comme je l’ai souligné, Gilead Pharmasset LLC est la titulaire actuelle du brevet 657.
[41] Gilead a déposé sa déclaration le 15 juin 2012, et Idenix sa défense et demande reconventionnelle le 19 novembre suivant. Depuis lors, les parties ont modifié plusieurs fois leurs actes de procédure.
D. Pharmasset synthétise le nucléoside 2’‑C‑Me/F
[42] Pendant la période de 2003 où Idenix tentait de synthétiser le composé 2’‑C‑Me/F, Pharmasset cheminait dans la même voie. Selon M. Patterson, un des chimistes au service de Pharmasset à l’époque, Pharmasset aurait entrepris la synthèse de composés 2’‑C‑Me/F après que Jeremy Clark, chimiste récemment embauché, eut constaté que ces composés n’étaient pas revendiqués dans les brevets américains 121 et 282 d’Idenix. Les chimistes de Pharmasset ont par la suite parlé du brevet avec cette omission comme du brevet d’Idenix. M. Stuyver prétend avoir relevé l’absence de revendication du composé 2’‑C‑Me/F dans un brevet d’Idenix, ce qui le qualifie en partie comme coïnventeur.
[43] M. Patterson a témoigné que, après avoir constaté l’absence de revendication dans le brevet d’Idenix, M. Clark s’est vu confier la tâche de synthétiser le composé 2’‑C‑Me/F. Après quelques mois d’efforts, en mai 2003 ou vers ce mois, M. Clark a réussi à synthétiser le nucléoside 2’‑C‑Me/F avec une base cytidine (le PSI‑6130). Les biologistes de Pharmasset ont mis à l’essai le PSI‑6130 sous la surveillance de Lieven Stuyver et ont constaté son activité contre l’hépatite C.
[44] Le 30 mai 2003 ou vers cette date, après la mise à l’essai du PSI‑6130, Pharmasset a déposé la demande de brevet américain 368 visant les nucléosides 2’‑C‑Me/F. Cette demande ne comportait aucune revendication. Elle désignait Jeremy Clark et Lieven Stuyver comme inventeurs.
E. M. Stuyver conteste la suppression de son nom du brevet de Pharmasset
[45] Le 21 avril 2004, Pharmasset a déposé la demande PCT relative au brevet 657, dans laquelle elle nommait uniquement Jeremy Clark comme inventeur. [EXPURGÉ]
[46] M. Stuyver prétend avoir relevé l’omission dans le brevet d’Idenix et avoir donné à M. Clark l’idée de synthétiser le composé 2’‑C‑Me/F en s’appuyant sur ses travaux dans d’autres brevets sur des molécules portant un fluor en position 2 (bas). Il prétend que Pharmasset a supprimé son nom par malveillance parce qu’il est retourné s’établir en Europe, et affirme avoir signé la déclaration sous la contrainte de M. Otto.
III. Les témoins
A. Les témoins experts
1) Les experts de Gilead
[47] Gilead a fait témoigner trois experts à l’instance, à savoir un chimiste spécialiste des nucléosides (M. Wnuk), un virologue (M. Seeger) et un chercheur dans le domaine pharmaceutique (M. Krise).
a) M. Stanislaw Wnuk
[48] M. Wnuk est professeur de chimie à l’Université internationale de Floride depuis 2002. Il est titulaire d’un doctorat en chimie organique de l’Université Mickiewicz de Poznan, en Pologne. De 1985 à 1986, il a fait de la recherche postdoctorale à l’Université de l’Alberta; ses spécialités étaient la synthèse d’analogues nucléosidiques modifiés et la mise au point de nouvelles réactions de fluoration. Il a travaillé dans le domaine de la chimie des nucléosides, y compris leur fluoration, pendant 30 ans. Il est l’auteur de plus de 180 publications, dont 80 % portent sur les nucléosides ou les nucléotides et 30 %, sur la fluoration.
[49] La Cour a estimé que M. Wnuk possédait les compétences voulues pour témoigner à titre d’expert dans les domaines suivants : la chimie organique, la chimie médicinale et la chimie des nucléosides; la synthèse des nucléosides, des nucléotides, des fluorothioéthers et de leurs analogues; les méthodes de fluoration utilisées pour la synthèse de nucléosides fluorés; la conception de méthodes de fluoration de thioéthers, d’alcools, de sucres, de nucléosides et de nucléotides, y compris de méthodes d’introduction d’un fluor aux positions 5’ et 2’ des nucléosides à base purique ou pyrimidique; les méthodes d’analyse et de purification utilisées pour la synthèse de composés organiques.
b) M. Christoph Seeger
[50] M. Seeger est professeur de virologie au Département de microbiologie du Fox Chase Cancer Center depuis 1990. Il a obtenu un doctorat en microbiologie de l’Université de Bâle en 1982, se spécialisant dans l’étude des rétrovirus. Son laboratoire produit des lignées cellulaires servant à l’étude du cycle de vie des virus de l’hépatite B et de l’hépatite C et au criblage de composés antiviraux. Le laboratoire de M. Seeger a été le deuxième aux États‑Unis et le troisième dans le monde à publier des articles sur l’essai sur réplicon du VHC et son utilisation pour l’évaluation et le criblage des composés antiviraux. Les travaux de M. Seeger sont financés depuis plus de 30 ans par les National Institutes of Health, et ses publications ont été citées plus de 3 500 fois. M. Seeger a plus de 30 ans d’expérience de recherche en virologie, dont une vaste expérience de l’étude du VHC.
[51] La Cour a estimé que M. Seeger possédait les compétences voulues pour témoigner à titre d’expert dans les domaines suivants : la biologie moléculaire et la virologie, en particulier les virus pathogènes pour l’humain, dont les virus de l’hépatite (virus de l’hépatite B (VHB), virus de l’hépatite C) et les modèles animaux pertinents (virus) appartenant à la famille des Hepadnaviridae ou des Flaviviridae; l’évaluation de l’utilité des nucléosides et des nucléotides dans le traitement des infections causées par ces virus; les modèles et les lignées cellulaires pour le criblage des composés antiviraux, dont les essais enzymatiques ou cellulaires, les méthodes de plage de lyse, les essais sur réplicon et les criblages à haut débit pour la découverte et la mise au point de composés antiviraux; l’interprétation des résultats des essais in vitro et des études chez les animaux pour l’évaluation de l’activité et de la toxicité des composés antiviraux.
c) M. Jeffrey Krise
[52] M. Krise est professeur agrégé de chimie pharmaceutique à l’Université du Kansas. Dans ses recherches, il s’attache à optimiser les propriétés médicamenteuses afin de maximiser l’utilité thérapeutique des médicaments. Il a reçu son diplôme de premier cycle en pharmacie en 1993 et a obtenu en 1998 un doctorat en chimie pharmaceutique avec distinction de l’Université du Kansas sous la houlette de Valentino Stella, éminent spécialiste des promédicaments. Il a procédé à la synthèse et à l’évaluation de nouveaux promédicaments en utilisant des phosphates pour améliorer l’hydrosolubilité de certains médicaments et a publié des articles à ce sujet. M. Krise a été jugé compétent pour présenter un témoignage d’expert dans les domaines suivants : les sciences pharmaceutiques; la pharmacocinétique (l’absorption, la distribution, le métabolisme et l’élimination); la formulation de médicaments; les promédicaments, les nucléosidiques et les nucléotidiques notamment; le métabolisme du sofosbuvir; la découverte et la mise au point de médicaments. Il a été le seul expert en promédicaments à témoigner en l’espèce.
2) Les experts d’Idenix
[53] Idenix a appelé trois experts à témoigner à l’instruction : deux chimistes (M. Damha et M. Barrett) et un virologue (M. Lamarre).
a) M. Masad Damha
[54] M. Damha est directeur du Département de chimie et titulaire de la chaire de chimie James McGill à l’Université McGill. Il était auparavant professeur de chimie et a occupé d’autres postes au même endroit depuis 1992. Il a été directeur du programme d’études supérieures du Département de chimie de 2000 à 2004, de 2006 à 2008 et en 2010. Il exerce des fonctions supérieures dans diverses sociétés : il est notamment président de l’Oligonucleotide Therapeutics Society et membre du conseil d’administration de l’International Society of Nucleosides, Nucleotides & Nucleic Acids; il siège à des comités consultatifs de rédaction; et il a reçu divers prix et distinctions dans le domaine de la science. Il a publié environ 155 articles dans des revues évaluées par les pairs et des chapitres d’ouvrages, dont beaucoup traitent de la synthèse d’analogues nucléosidiques. Il a présenté à titre de conférencier invité à des rencontres nationales ou internationales plus de 80 exposés sur la chimie bio‑organique, notamment la synthèse des nucléosides, des nucléotides et des oligonucléotides. Il a fait partie du comité organisateur de la table ronde internationale sur les nucléosides, les nucléotides et les acides nucléiques qui a eu lieu à Montréal en 2012.
[55] M. Damha a été jugé compétent pour témoigner à titre d’expert dans les domaines suivants : la chimie médicinale et la chimie bio‑organique, notamment la conception, la synthèse et l’analyse des nucléosides et de leurs analogues en vue de leur utilisation en tant qu’agents antiviraux, y compris les stratégies faisant appel à des promédicaments.
b) M. Anthony Barrett
[56] M. Barrett est titulaire de la chaire Glaxo en chimie organique et directeur du Wolfson Centre for Organic Chemistry in Medical Science au Département de chimie de l’Imperial College of Science, Technology and Medicine (IC) de Londres en Angleterre. Il est aussi titulaire de la chaire Derek Barton en chimie de synthèse et directeur de la section Synthèse du Département de chimie de l’IC. Il est membre de la Royal Society et de l’Academy of Medical Sciences. Il a formé 127 étudiants au doctorat et 192 associés de recherche postdoctorale sur divers thèmes de recherche en chimie organique, y compris en chimie organique de synthèse et en chimie médicinale. Il a publié 408 articles évalués par les pairs sur divers aspects de la chimie organique. Vingt-neuf de ces articles portaient sur la synthèse des glucides et des nucléosides, sujets d’intérêt en l’espèce. Il a reçu des prix de diverses organisations, comme la Royal Society of Chemistry et l’American Chemical Society, pour sa contribution à la chimie organique.
[57] M. Barrett a été jugé compétent pour témoigner à titre d’expert dans les domaines suivants : la chimie organique et la chimie médicinale, notamment la synthèse des nucléosides et des glucides, les techniques et les procédures de chimie analytique utilisées en chimie de synthèse, dont les techniques servant à l’interprétation des résultats, et les pratiques de laboratoire normalisées des chimistes de synthèse.
c) M. Daniel Lamarre
[58] M. Lamarre est professeur de biochimie et directeur du laboratoire de recherche en immunovirologie moléculaire de l’Université de Montréal. Il a occupé un certain nombre de postes supérieurs dans le domaine de la recherche chez Boehringer Ingelheim à Laval (Québec); ses travaux étaient axés sur le VHC et la découverte de composés antiviraux. Il a reçu nombre de bourses et de distinctions et a été titulaire de nombreuses chaires de recherche. Il a supervisé trois équipes d’environ 25 scientifiques lors des travaux de criblage visant à identifier des molécules ayant une activité biologique contre le VHC grâce à leur capacité d’inhiber la protéase NS3, l’hélicase NS3 et la polymérase NS5B. Il a participé à plusieurs découvertes importantes, qu’il s’agisse de l’agent antiviral ciluprevir ou de la découverte et de la mise au point d’autres importants médicaments candidats contre le VHC ou le VIH.
[59] M. Lamarre a été jugé compétent pour témoigner à titre d’expert dans les domaines suivants : la biochimie avec une expertise particulière en virologie, la découverte et la mise au point de médicaments en milieu industriel, et la conception rationnelle de médicaments basée sur la structure. Il possède une expertise particulière en ce qui concerne le VHC et la famille des Flaviviridae.
3) Observations concernant les témoins
[60] Gilead a fait valoir que, parmi les témoins experts en synthèse des nucléosides, M. Wnuk était le seul à avoir les compétences voulues pour témoigner dans le domaine de la chimie du fluor. Elle estimait aussi que ni M. Damha ni M. Barrett n’avaient les compétences voulues selon la Cour pour présenter un témoignage d’expert en ce qui concerne la chimie du fluor ou la fluoration des nucléosides.
[61] Je ne suis pas d’accord pour dire que MM. Damha et Barrett n’ont pas les compétences voulues pour parler de la fluoration chimique des nucléosides. Il apparaît cependant que M. Wnuk a consacré sa carrière à la synthèse des nucléosides, dont une grande partie de son temps à la fluoration des nucléosides. J’estime qu’il s’agit d’un facteur de pondération de la preuve des experts adverses qui favorise Gilead en ce qui a trait aux questions de fluoration.
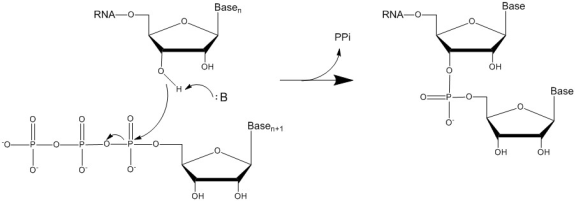
[62] Gilead maintient en outre que M. Wnuk est le seul expert qui avait une expérience personnelle dans le domaine de la fluoration pendant la période visée et qu’il possède donc les compétences voulues pour exprimer une opinion à ce sujet grâce à son expérience de première main acquise en 2003‑2004. Ce jugement me paraît juste. M. Barrett reconnaît que les questions de chimie en litige en l’espèce ne présentaient pas d’intérêt pour lui pendant la période pertinente. De même, M. Damha n’avait aucune expérience de la fluoration des nucléosides en 2003‑2004.
[63] C’est là une observation juste, puisque la compétence acquise en fluoration des nucléosides dans la période pertinente représente un avantage. Ceci est particulièrement pertinent en vue d’expliquer les limites des connaissances générales courantes en cette matière et la nature des expériences à cette époque, plutôt que de formuler des avis fondés sur un examen a posteriori de documents écrits fournis aux témoins ou issus de recherches effectuées une décennie après les événements.
[64] Gilead a également critiqué les dépositions de MM. Damha et Barrett en ce qui concerne les qualités supérieures qu’ils ont attribuées au chimiste versé dans l’art. M. Damha a déclaré que les capacités de raisonnement et de résolution de problèmes de la personne versée dans l’art supposaient une certaine créativité, ce qu’il a expliqué par le fait que depuis l’obtention de son diplôme, la personne en question aura contribué en certains points à enrichir les connaissances dans le domaine.
[65] Je souscris à l’observation de Gilead selon laquelle les connaissances et les compétences ainsi attribuées vont plus loin que celles du chimiste fictif versé dans l’art. Les opinions de M. Damha concernant les réalisations du chimiste versé dans l’art dans la synthèse de nouveaux composés appellent dès lors une certaine retenue.
[66] J’estime que M. Barrett va également trop loin dans sa description des compétences élémentaires de la personne versée dans la découverte de médicaments lorsqu’il déclare qu’elle [traduction] « est brillante en matière de réactions, mais pas inventive ». Eu égard aux compétences supérieures en laboratoire qu’il attribue à la personne moyennement versée dans l’art (le chimiste versé dans l’art), j’accorderai un peu moins de poids à son opinion concernant la capacité d’une telle personne à synthétiser des composés en procédant par tâtonnement. C’est un point que je retiens également pour tempérer les propos de M. Barrett lorsqu’il affirme que la synthèse du composé 2’‑C‑Me/F était très évidente et, à l’inverse, ses critiques acerbes des vaines tentatives de M. Griffon de synthétiser le composé visé.
[67] J’ai formulé quelques observations lorsque j’estimais que les témoins allaient trop loin. Dans l’ensemble, je n’ai pas trouvé que leur contre‑interrogatoire ait joué un rôle prépondérant dans l’instruction. Je me suis rangé aux avis de différents témoins sur différentes questions, suivant la teneur de leurs avis et la mesure dans laquelle ils étaient étayés, plutôt que la manière dont les témoignages ont été offerts. J’ai aussi été enclin à accorder plus de poids à la déposition de témoins ayant pris part aux événements de 2003‑2004 lorsque celle‑ci contredisait l’opinion des experts.
B. Les témoins factuels
1) Les témoins factuels de Gilead
[68] Gilead n’a produit la preuve d’aucun témoin factuel relativement à la demande principale, mais s’est appuyée sur des aveux et des lectures des interrogatoires préalables. Je l’ai aussi autorisée à déposer le témoignage étranger d’un ancien chimiste d’Idenix, M. Alistair Stewart. Gilead a appelé à témoigner un témoin factuel (M. Otto) relativement à la demande reconventionnelle d’Idenix contestant la paternité de l’invention.
a) M. Alistair Stewart
[69] M. Stewart était directeur, Chimie, fabrication et mesures de contrôle, chez Idenix à Cambridge, au Massachusetts. Il a obtenu un doctorat en chimie organique de l’Université d’Oxford en 2003 sous la direction du professeur George Fleet. M. Stewart est entré chez Idenix en septembre 2003 à titre de chercheur scientifique 1 au sein du groupe de chimie des procédés. Il a travaillé à un projet de fabrication de nucléosides 2’‑C‑Me/F du milieu de 2004 au début de 2005 et a supervisé le travail de Mme Jingyang Wang. M. Stewart n’a pas été appelé à témoigner à l’instruction. Cependant, après avoir entendu les observations des parties par suite d’une requête écrite, j’ai autorisé Gilead à déposer en preuve dans la présente instance la déclaration de témoin de M. Stewart ainsi que la transcription d’un contre‑interrogatoire connexe provenant d’une instance britannique; je le justifie au regard des efforts d’Idenix en vue de synthétiser les composés 2’‑C‑Me/F et de la déposition connexe de Mme Wang dans le cadre de l’instance britannique, qui a été admise sur consentement.
b) M. Michael J. Otto
[70] M. Otto a occupé le poste de conseiller scientifique en chef chez Pharmasset Inc de 1998 à 2012. Son rôle consistait à superviser le programme de chimie et de biologie, à coordonner les travaux de recherche et à diriger le programme de mise au point d’un médicament contre le VIH. Il détient un doctorat en microbiologie du Medical College du Wisconsin. Son témoignage a porté sur la découverte du PSI‑6130, le dépôt des demandes de brevet s’y rapportant, et son souvenir des événements intéressant le rôle que M. Lieven Stuyver aurait joué dans la découverte du PSI‑6130 en sa qualité d’inventeur.
2) Les témoins factuels d’Idenix
[71] Idenix a appelé six témoins factuels à témoigner à l’instruction (MM. Standring, Griffon, Patterson, Clemens et Stuyver et le professeur La Colla). Les parties ont consenti à l’admission du témoignage étranger d’un septième témoin, Mme Wang, à la place de son témoignage de vive voix à l’instruction.
a) M. David Standring
[72] M. Standring détient un doctorat en chimie bio‑organique de l’Université Harvard. Il a occupé divers postes de gestion de niveau supérieur chez Idenix Pharmaceuticals Inc à Cambridge, au Massachusetts, de 2000 à 2013, date de son départ de la société. Il n’est pas désigné comme un inventeur sur le brevet 191. Il n’a joué aucun rôle dans les travaux de chimie ayant porté sur les composés en litige.
b) Le professeur Paolo La Colla
[73] Le professeur La Colla est professeur de microbiologie à Cagliari et a occupé de 2002 à 2008 le poste de directeur du Département des sciences biomédicales et de la technologie à l’Université de Cagliari. Il a supervisé les travaux réalisés conjointement à l’Université de Cagliari par l’Université de Cagliari et Idenix Pharmaceuticals Inc concernant la mise à l’essai de composés contre le VIH, le VHB et le VHC. Le professeur La Colla n’a pris aucune décision quant au choix des composés à mettre à l’essai et n’a pas pris part à leur synthèse. Il était le seul inventeur désigné dans le brevet 191 (sur les quatre) appelé comme témoin dans la présente instance.
c) M. Steven Patterson
[74] M. Patterson est titulaire d’un doctorat en chimie organique avec mineure en biochimie de l’Université d’État de Géorgie. Il a travaillé chez Pharmasset de février 2000 au mois de juin ou juillet 2004. Il a pris la direction du groupe de chimie analytique en février 2003 ou vers ce mois. Appelé à témoigner par Idenix, il a parlé de l’idée de fabriquer des composés 2’-fluor (bas)-2’‑méthyl (haut) chez Pharmasset et a précisé que Jeremy Clark avait été le premier à créer un tel composé.
d) M. Jean‑François Griffon
[75] M. Griffon est chercheur scientifique principal d’Idenix à Montpellier au sein du groupe des analogues nucléosidiques. Il a obtenu en 1998 un doctorat en chimie organique de l’Université de Montpellier au laboratoire du professeur Jean‑Louis Imbach sous la supervision de M. Gilles Gosselin. M. Griffon a synthétisé un certain nombre de nucléosides substitués par un fluor en position 2’ et 3’ pendant ses études de doctorat et est entré chez Idenix en 2001. Le 28 mars 2002, il s’est vu confier la tâche de synthétiser des nucléosides 2’-fluoro (bas)-2’‑méthyl (haut) et a travaillé à ce projet jusqu’au milieu de 2004.
e) M. Lieven Stuyver
[76] M. Stuyver a obtenu un doctorat en génétique humaine en 1992 et a dirigé le groupe de biologie chez Pharmasset de 1998 à 2004. Il est désigné comme inventeur dans la demande de brevet américain provisoire 368, invoquée comme la demande de priorité par rapport au brevet 657, mais n’a pas été nommé dans la demande de brevet PCT ayant abouti à la demande de brevet canadien 657, ni dans le brevet lui‑même.
f) Mme Jingyang Wang
[77] Mme Jingyang Wang est chercheuse principale d’Idenix à Cambridge, au Massachusetts. Elle a obtenu un baccalauréat ès sciences en chimie à l’Université Nankai de Tianjin, en Chine, en 1989, une maîtrise ès sciences en chimie organique en 1995 de l’Université de Manchester, au Royaume-Uni, et une maîtrise ès sciences en chimie organique en 1998 de l’Université du Maine. Elle est entrée chez Idenix Pharmaceuticals Inc en 2002 à titre de chimiste de procédés et y a été promue chercheuse en mai 2004. Elle a travaillé à un projet de création de nucléosides 2’‑fluoro (bas)-2’‑méthyl (haut) de la fin de 2004 au début de 2005 sous la direction de M. Alistair Stewart. Les parties ont accepté que la déclaration de témoin de Mme Wang et le contre‑interrogatoire connexe provenant de l’instance britannique soient versés en preuve dans la présente instance à la place de son témoignage de vive voix.
g) M. Alexander Clemens
[78] M. Clemens est chimiste de procédés chez AMRI. Il a effectué les expériences demandées par Idenix en juin et en juillet 2014 et a répété ces expériences en août 2014 en vue de démontrer que M. Griffon avait bel et bien synthétisé un nucléoside 2’‑C‑Me/F sans s’en rendre compte. Il n’a pas été associé à l’élaboration des protocoles des expériences.
C. Le défaut de Jeremy Clark de témoigner
[79] Aucune partie n’a appelé M. Clark à témoigner. Idenix a soutenu à un moment que la Cour devrait en tirer une inférence défavorable à Gilead. M. Otto a évoqué dans le cadre de son témoignage la relation tendue entre M. Clark et Pharmasset (aujourd’hui Gilead). Ce dernier estimait qu’il n’avait pas été convenablement indemnisé pour son invention. Il a envoyé des lettres à la société, communiqué avec ses avocats et intenté contre elle et M. Schinazi des actions en justice. Même s’il est un ancien employé, il ne relève pas du contrôle de Gilead. Il n’a pas témoigné dans l’instance britannique. Il n’est pas surprenant qu’il n’ait pas témoigné en l’espèce.
[80] Gilead laisse entendre pour sa part que c’est Idenix qui aurait dû appeler M. Clark à témoigner. Cette dernière l’a soumis à un interrogatoire préalable et l’a questionné toute une journée sur ses travaux. Gilead fait aussi remarquer qu’Idenix a avancé des allégations à ce chapitre et que le fardeau de la preuve concernant ces faits lui incombait donc. Gilead invite la Cour à inférer que le témoignage de M. Clark n’aurait pas aidé Idenix. Je ne vois pas en quoi cela incitait ou obligeait Gilead à appeler M. Clark à témoigner. Idenix disposait de sa déposition grâce à l’interrogatoire préalable auquel elle l’avait soumis, et aurait pu l’appeler à témoigner. Du reste, M. Patterson a décrit M. Clark comme quelqu’un doté d’un tempérament assez particulier. Le défaut d’avoir appelé M. Clark à témoigner ne me porte à tirer aucune inférence défavorable à l’une ou l’autre des parties.
IV. Les principes scientifiques et leurs rapports avec les questions à trancher
[81] Voici une introduction succincte des principes de chimie et de biologie qui doivent éclairer la présente décision et une analyse de leurs rapports avec les questions à examiner. Les informations scientifiques générales sont extraites des rapports d’expert et des observations des parties.
A. La notation chimique
[82] Les questions de chimie visées dans la présente affaire relèvent en majeure partie du domaine de la chimie organique. La chimie organique est la chimie du carbone. Chaque atome de carbone dans une molécule organique est communément capable de former quatre liaisons avec d’autres atomes. On peut caractériser les atomes de carbone selon le nombre d’autres carbones en liaison avec eux. Un « carbone primaire » est un carbone lié à un seul atome de carbone. Les carbones liés à deux ou à trois atomes de carbone sont dits secondaires ou tertiaires. Les carbones liés à des alcools sont des alcools secondaires ou tertiaires.
B. Les cycles glucidiques, les nucléosides, les nucléotides et les acides nucléiques
[83] Les brevets 191 et 657 concernent principalement des nucléosides et des nucléotides modifiés au niveau du carbone 2 du cycle glucidique (cycle aussi appelé ribose en l’espèce). Les nucléosides et les nucléotides sont des composés formés d’une base hétérocyclique (aussi appelée « base » ou « nucléobase ») liée à un cycle glucidique.
[84] Les nucléosides et les nucléotides sont les constituants de base des acides nucléiques. Le terme « acide nucléique » est un terme général qui désigne un polymère (une grosse molécule composée de nombreuses sous-unités répétées) formé de nucléotides reliés entre eux par des liaisons. L’acide désoxyribonucléique (ADN) et l’acide ribonucléique (ARN) sont les principaux acides nucléiques dans les cellules qui servent à coder et à transporter l’information génétique dans les organismes vivants.
[85] Le génome du VHC est composé d’un ARN simple brin à polarité positive. Les nucléosides ou nucléotides modifiés sont conçus pour imiter les nucléosides naturels qui sont incorporés par le VHC pour former l’ARN. Lorsque cela se produit, les analogues nucléotidiques permettent de traiter l’hépatite C en perturbant le processus de réplication viral, lequel est essentiel à la formation de nouveaux virus.
1) Le cycle glucidique
[86] Le cycle glucidique peut se présenter sous la forme d’un cycle à cinq constituants comportant un atome d’oxygène. Les cycles glucidiques de l’ARN et de l’ADN sont respectivement le ribose et le désoxyribose. Ils sont identiques, sauf à la position 2’ « bas » : le ribose de l’ARN contient un groupe hydroxyle en position 2’-C (bas), alors que le désoxyribose de l’ADN contient un atome d’hydrogène à cette même position. Ils peuvent être représentés de la manière suivante par une « projection de Haworth » :
[87] La projection de Haworth est un moyen courant de représenter la structure des cycles glucidiques, des nucléosides, des nucléotides et des promédicaments avec une perspective tridimensionnelle. Elle indique si les substituants sont fixés au‑dessus (haut) ou au‑dessous (bas) du plan du cycle glucidique. Les atomes d’hydrogène du cycle ne sont pas représentés. Quant aux atomes de carbone, ils sont représentés comme un sommet (point de convergence de deux lignes droites ou plus) ou un trait sans symbole de carbone. Les positions relatives des carbones sur le pourtour du cycle glucidique sont indiquées par le numéro de l’atome de carbone accompagné du symbole « prime » (‘).
2) Les nucléosides
[88] Un nucléoside est un composé chimique constitué d’une base et d’un cycle glucidique. Le cycle et la base sont reliés entre eux par une liaison chimique appelée « liaison glycosidique ». La glycosylation, ou condensation sucre‑base, est le processus de couplage du sucre et de la base. Un exemple de nucléoside figure ci‑après. Dans le dessin, l’organisation spatiale des constituants est illustrée à l’aide de coins et de traits représentant les liaisons suivantes : la ligne droite représente une liaison dans le plan du papier; le coin représente une liaison qui sort de la page (position (haut)); la ligne hachurée représente une liaison entrant dans la page (position (bas)).
[89] L’ADN et l’ARN utilisent tous deux des combinaisons de bases pour leur fonction de codage. Dans l’ADN, les bases sont la thymine, l’adénine, la cytosine et la guanine. Dans l’ARN, la thymine est remplacée par l’uracile. L’adénine et la guanine sont des « purines » et contiennent deux cycles fusionnés. La cytosine, la thymine et l’uracile ne renferment qu’un seul cycle et sont des « pyrimidines ». On désigne ces bases par une lettre unique (A, C, G, T ou U).
[90] La numérotation des atomes dans les bases s’effectue conformément aux conventions, c’est‑à‑dire :
C. La stéréochimie
[91] La stéréochimie est l’étude de l’organisation spatiale tridimensionnelle des atomes qui forment la structure des molécules et de leur manipulation. Les stéréoisomères sont des isomères qui diffèrent en raison de l’organisation spatiale de leurs atomes plutôt que par l’ordre des liaisons atomiques. Une branche importante de la stéréochimie est l’étude des molécules chirales. Une molécule chirale se présente sous deux formes en miroir l’une de l’autre.
[92] La molécule chirale et son image miroir sont ce qu’on appelle des énantiomères.
[93] Les énantiomères ont des propriétés physico‑chimiques identiques, qu’il s’agisse des points d’ébullition et de fusion, de la densité ou de l’indice de réfraction. Ils diffèrent toutefois par leur interaction avec la lumière polarisée, et ils peuvent avoir des propriétés biologiques différentes. Un mélange à parts égales d’énantiomères est appelé « mélange racémique ».
[94] Les diastéréoisomères (ou diastéréomères) sont des stéréoisomères d’un composé comportant deux centres de chiralité ou plus qui ne sont pas une image miroir d’un autre stéréoisomère du même composé.
[95] Le dessin ci‑après permet de distinguer ces termes :
[96] Le procédé consistant à appliquer un réactif de Grignard aux structures du brevet 191, lequel décrit la synthèse des composés 2’‑C‑Me/OH, aboutirait à la création d’un mélange racémique de diastéréomères des composés 2’‑C‑Me/OH et 2’‑C‑OH/Me. Ces diastéréomères peuvent être séparés de façon à obtenir l’énantiomère 2’‑C‑OH/Me souhaité, molécule intermédiaire utilisée pour la synthèse du composé 2’‑C‑Me/F cible.
D. La fluoration
[97] La fluoration est l’adjonction d’au moins un atome de fluor à un composé. En janvier 2004, deux mécanismes réactionnels de fluoration étaient connus : la fluoration électrophile et la fluoration nucléophile. Les produits de départ et les réactifs n’étaient pas les mêmes dans les deux types de fluoration.
[98] Voici les agents de fluoration électrophile qui étaient connus le 8 janvier 2004 : F2; SelectFluor; N‑fluorobenzènesulfonimide; et ClO3F. Les agents de fluoration nucléophile connus à cette même date étaient les suivants : HF et réactifs à base de HF (p. ex., HF‑pyridine, HF‑pyridine/AlF3, HF anhydre, HF/Fe (AcAc)3; AgF et réactifs à base d’AgF (AgF/NH4F); Et3N●3HF; KF et réactifs à base de KF (p. ex., KHF2); DAST; Deoxo‑Fluor®; fluorure de tétrabutylammonium (TBAF); difluorotriméthylsilicate de tris(diméthylamino)sulfonium (TASF); Bu4NH2F3; Bu4NHF2/Fe(AcAc)3; et fluorure de perfluoro ‑1‑butanesulfonyle (PBSF).
[99] Les composés 2’‑C‑Me/F ont d’abord été synthétisés à l’aide de l’agent de fluoration nucléophile DAST et ensuite à l’aide d’une version plus stable de cet agent, connu sous le nom de marque Deoxo‑Fluor®.
E. Les réactions de substitution nucléophile
[100] Un nucléophile (agent de fluoration nucléophile comme le DAST) est une espèce chimique riche en électrons qui réagit avec une espèce pauvre en électrons, appelée électrophile, pour produire une nouvelle molécule. La réaction entre un nucléophile et un électrophile est ce qu’on appelle une réaction de substitution nucléophile. Dans une telle réaction, le nucléophile réagit avec l’électrophile et une autre entité, appelée le groupe partant, est libérée.
1) Les mécanismes des réactions de substitution nucléophile
[101] Les réactions de substitution nucléophile peuvent s’effectuer par deux différents mécanismes réactionnels appelés SN1 et SN2 aux conséquences stéréochimiques différentes.
[102] Dans le « mécanisme SN2 », l’inversion stéréochimique est complète et donne un produit unique, ce qu’illustre schéma ci‑après. Le produit de départ comporte un atome d’hydrogène au‑dessus du plan et un groupe hydroxyle au‑dessous du plan. Le produit résultant comporte un atome d’hydrogène au‑dessous du plan et un atome de fluor au‑dessus du plan, d’où le terme « inversion ».
[103] En revanche, le « mécanisme SN1 » donne un mélange de stéréoisomères, ce qu’illustre le schéma suivant :
[104] Un certain nombre de facteurs déterminent si la réaction de substitution nucléophile s’effectuera par le mécanisme SN1 ou SN2 : degré et type de substitution, encombrement stérique du substrat, puissance du nucléophile, stabilité du groupe partant, solvant utilisé, etc.
[105] Gilead a synthétisé le nucléoside 2’‑C‑Me/F avec le composé 2’‑C‑OH/Me par fluoration SN2 de l’alcool tertiaire de ce composé avec inversion de la stéréochimie résultante.
F. Les groupes protecteurs
[106] Un nucléoside (et un sucre) a de multiples sites réactionnels possibles. Dans une séquence de synthèse, il est possible que certains de ces sites doivent être bloqués afin d’empêcher toute réaction chimique de sorte qu’une transformation chimique sélective puisse s’opérer au site réactionnel ciblé. Un groupe protecteur est un groupe fonctionnel temporairement placé à un site réactionnel possible du nucléoside de manière à le soustraire à toute réaction non voulue. Le groupe protecteur peut être retiré une fois achevée la transformation désirée. Certains groupes protecteurs sont plus compatibles avec certaines conditions réactionnelles.
G. L’isolement des molécules
[107] Après une réaction, les chimistes doivent isoler et purifier les produits réactionnels afin de les analyser et de les caractériser. Le plus souvent, ils recourent pour ce faire à la chromatographie.
[108] La chromatographie permet la séparation des composés d’après leur répartition différente entre une phase mobile et une phase stationnaire. La phase mobile est d’ordinaire un solvant ou un mélange de solvants et la phase stationnaire, un solide inorganique comme la silice ou l’alumine. En chromatographie, on fait généralement passer à travers la phase stationnaire une solution contenant un mélange de produits. Vu leur différence de répartition, les produits du mélange progressent (s’éluent) à différentes vitesses dans la phase stationnaire et sont recueillis séparément et évaporés.
[109] Trois grands types de chromatographie présentent un intérêt en l’espèce : la chromatographie sur couche mince (CCM), la chromatographie sur colonne (CC) et la chromatographie en phase liquide à haute performance (CPLHP).
1) La chromatographie sur couche mince
[110] La CCM est communément utilisée pour observer l’évolution d’une réaction. C’est une méthode simple, économique, efficace et relativement rapide qui permet au chimiste d’analyser un mélange réactionnel et de surveiller les progrès d’une réaction et le degré de conversion du produit de départ. Elle permet aussi de mesurer de façon empirique et approximative la pureté d’un ou de plusieurs produits.
[111] En CCM, on recouvre généralement une plaque de verre ou d’alumine d’une phase stationnaire, le plus souvent de la silice ou de l’alumine. Une petite quantité de chaque solution d’intérêt est déposée à un point précis sur la plaque à une distance prédéterminée du bas. Une petite quantité du mélange réactionnel est déposée sur la plaque, et le bas de la plaque est placé dans une petite quantité de solvant ou de mélange de solvants qui migre vers le haut de la plaque par capillarité. Les composés du mélange sont entraînés avec la phase mobile à des vitesses différentes selon leur degré d’interaction avec la silice ou l’alumine. On sépare les composés du mélange réactionnel selon leurs différences de solubilité, de polarité et d’absorption.
[112] Quand il surveille une synthèse organique, le chimiste peut placer le produit de départ dans la piste de gauche d’une plaque de CCM et le mélange réactionnel dans la piste de droite. Si les deux pistes montrent les mêmes tâches sur la plaque, le chimiste supposera normalement qu’aucune réaction n’a eu lieu. S’il y a une tache sur la plaque qui n’est pas présente sur la piste originale, le chimiste en déduira qu’un produit de réaction a été obtenu. S’il y a plusieurs nouvelles taches sur la nouvelle piste, il en déduira que plusieurs produits réactionnels se sont formés.
[113] Une plaque de CCM peut être utilisée après la séparation des produits réactionnels pour déterminer si un sucre s’est formé, un nucléoside 2’‑C‑Me/F, par exemple. La plaque de CCM est colorée à l’acide sulfurique, lequel carbonise de façon préférentielle les glucides, tels les sucres. Les taches qui contiennent un sucre apparaissent plus foncées à la lumière ultraviolette, alors que les composés non glucidiques (par exemple une base non liée à un sucre) ne seront pas aussi foncés
2) La purification par chromatographie
[114] On se sert de diverses méthodes chromatographiques pour séparer les composés des mélanges à des fins d’analyse : la chromatographie sur colonne (CC), la chromatographie en phase liquide à haute performance (CPLHP) et la CPLHP en phase inverse.
[115] En chromatographie sur colonne, on verse la phase mobile – le mélange réactionnel – sur la phase stationnaire – une colonne normalement constituée de gel de silice. Du solvant est continuellement ajouté, et les fractions sont éluées à la base de la colonne. Les composés du mélange réactionnel traversent la phase stationnaire à différentes vitesses. Les produits réactionnels sont recueillis à la main dans des fioles, et les produits similaires sont combinés puis analysés.
[116] La CPLHP est similaire à la chromatographie sur colonne. Il s’agit toutefois d’une technique chromatographique plus complexe dans laquelle la phase mobile est pompée sous pression dans une phase stationnaire finement divisée et un détecteur décèle les changements de composition de la solution éluée. D’ordinaire, la CPLHP est une technique de séparation bien plus efficace que la chromatographie sur colonne.
H. La caractérisation des molécules
[117] La chromatographie sert à séparer les produits réactionnels, mais pas à les caractériser. Il existe de nombreuses méthodes de caractérisation moléculaire. Les deux méthodes pertinentes en l’espèce sont la spectrométrie de masse (SM) et la résonance magnétique nucléaire (RMN).
1)
 La spectrométrie de masse
La spectrométrie de masse
[118] L’analyse par SM permet d’obtenir un spectre de masse pouvant révéler la composition moléculaire et les caractéristiques structurales d’un composé. Couplée à la CPLHP, elle permet de séparer les éléments d’un mélange et de les caractériser à l’aide d’une seule technique.
2) La résonance magnétique nucléaire
[119] La spectroscopie RMN est une technique fréquemment employée pour caractériser
la structure des composés. Elle permet de déterminer la structure complète ou
partielle d’un composé en renseignant sur la nature des groupes d’atomes
présents et sur leurs liaisons.
[120] Elle peut également servir à authentifier un échantillon d’un composé par comparaison avec le spectre RMN d’un échantillon authentique. Elle est la principale méthode qu’utilisent les chimistes pour caractériser des composés inconnus et authentifier d’autres échantillons.
3) La chromatographie en phase liquide à haute performance couplée à la spectrométrie de masse (CPLHP‑SM)
[121] La CPLHP couplée à la spectrométrie de masse (SM) est une technique plus récente employée pour séparer et caractériser des composés réactionnels. Il s’agit d’introduire une petite quantité de mélange réactionnel dans une colonne de CPLHP. Au sortir de la colonne, l’éluant passe immédiatement dans un spectromètre de masse, ce qui permet au chimiste de déterminer, en temps réel et en continu, la masse moléculaire des composés qui sortent de la colonne.
I. Les nucléotides et la formation de l’acide ribonucléique (ARN) et de l’acide désoxyribonucléique (ADN)
[122] Les nucléosides sont les précurseurs des nucléotides. Les nucléotides sont des nucléosides contenant un phosphate lié à l’atome oxygène de l’unité alcool (hydroxyle) du sucre. Un nucléotide se définit comme un nucléoside à groupe mono-, di‑ ou triphosphate lié au cycle glucidique en position 2’, 3’ et/ou 5’, la position 5’ étant la plus courante, comme c’est le cas en l’espèce. Dans le sofosbuvir, le nucléotide, promédicament du 2’‑C‑Me/F, porte un monophosphate en position 5’.
[123] Voici une illustration des trois formes de nucléotide :
[124] La conversion d’un nucléoside en nucléotide par fixation d’un phosphate (PO35‑, par exemple) sur l’unité alcool en position C‑5 est un processus chimique possible à l’état naturel in vivo (à l’intérieur de la cellule). La conversion s’amorce après l’entrée dans la cellule du nucléoside ou du nucléotide monophosphate. L’entrée dans la cellule est facilitée par le recours à des « promédicaments », dont il sera question ci‑après.
[125] Une fois à l’intérieur de la cellule, le nucléoside, ou le nucléotide mono‑ ou diphosphate, subit jusqu’à trois étapes consécutives de phosphorylation au groupe hydroxyle fixé en C‑5’ et forme des nucléotides mono‑, di‑ et triphosphate en position 5’. La phosphorylation est un processus métabolique possible in vivo dans lequel un groupe phosphate s’ajoute naturellement à un nucléoside ou à un nucléotide mono‑ ou diphosphate pour former un nucléotide. La phosphorylation est catalysée par des enzymes appelées kinases.
[126] Une polymérase est une enzyme qui peut combiner les nucléotides pour former des brins d’ADN ou d’ARN. Pour qu’elle lie les nucléotides entre eux, il faut que ceux‑ci soient sous forme triphosphate (trois groupes phosphate en position 5’ du cycle glucidique). Dans le cas des ribonucléosides, un groupe hydroxyle en position 3’ (groupe 3’-OH) d’un nucléotide se liera à un groupe phosphate en position 5’ du nucléotide qui suit, formant ainsi un pont phosphate. Par ce processus, le triphosphate est reconverti en monophosphate, lequel forme un pont phosphate avec le nucléotide suivant.
[127] Bref, dans la machinerie cellulaire de réplication de l’ADN et de l’ARN, un nucléoside triphosphate est le produit de départ nécessaire à la formation d’un pont phosphate vers le nucléotide adjacent pour former un brin d’ADN ou d’ARN en croissance. Les enzymes appelées kinases sont responsables de la phosphorylation des nucléosides et des nucléotides mono‑ et diphosphate. Les polymérases sont les enzymes chargées de la synthèse des brins d’ARN ou d’ADN en croissance.
J. Les virus
[128] Les virus sont les plus petits de tous les organismes autoréplicables. Bien qu’ils soient autoréplicables, ils n’ont aucun métabolisme propre, étant plutôt obligés d’envahir les cellules et de mobiliser la machinerie subcellulaire pour leur multiplication. Tous les virus portent un génome formé d’acide nucléique viral (ARN ou ADN) enveloppé d’une couche protéique appelée capside. Les virus infectent les organismes vivants et utilisent les mécanismes de reproduction cellulaire de leur hôte pour se multiplier. Comme dans une cellule normale, les acides nucléiques représentent le matériel génétique des virus. Les virus ont leur propre polymérase appelée polymérase virale. On peut les caractériser selon que leur matériel génétique est constitué d’ARN ou d’ADN.
[129] Les virus sont classés par familles. Une famille virale peut comprendre 10, 20 ou 30 virus. La famille des Flaviviridae comprend un grand nombre de virus très préoccupants à l’échelle mondiale qui infectent tant les humains que les animaux.
[130] La famille des Flaviviridae compte trois genres : les flavivirus, les hepacivirus et les pestivirus. En voici des exemples :
[131] Les Flaviviridae affichent des similitudes dans leur génome (leur code génétique, qui renferme le modèle des protéines nécessaires à la réplication virale), dont l’ARN polymérase. Tous les virus de cette famille possèdent une ARN polymérase (NS5 des flavivirus, NS5B des pestivirus et NS5B des hepacivirus) qui réplique l’ARN de la même façon à l’aide de nucléosides triphosphates.
1) L’hépatite C
[132] Le VHC est l’un des plus importants virus de la famille des Flaviviridae en raison de sa grande incidence sur la santé humaine. L’hépatite C est une maladie du foie qui se transmet par contact de sang à sang, y compris par le sang et les produits sanguins contaminés. Une fois l’infection installée, le virus se réplique sans cesse et se propage dans les hépatocytes (cellules hépatiques). Le VHC infecte environ 185 millions de personnes (ce qui représente en gros 2,2 % de la population humaine), et la transmission de ce virus demeure un grand problème de santé publique.
[133] Le trait le plus notable des infections à VHC est leur persistance habituelle, souvent sur des décennies, et plus de 70 % des hépatites C aiguës évoluent vers une hépatite chronique. Les personnes souffrant d’hépatite chronique sont prédisposés à l’hépatite chronique active, à la cirrhose du foie et au carcinome hépatocellulaire qui, tous, causent chaque année des centaines de milliers de décès. Le taux de mortalité associé au VHC continuera à monter pendant au moins 10 ans à cause des décennies de décalage entre l’infection aiguë et l’insuffisance hépatique.
2) Le génome du VHC
[134] Le génome du VHC est constitué d’un ARN simple brin à polarité positive. Voici comment il est structuré :
[135] Les protéines non structurales (NS) codées par ce génome participent à la réplication virale et à la synthèse des protéines. En voici des exemples :
a) NS3 – protéase qui aide à transformer la polyprotéine en protéine mature en la clivant au niveau de certaines séquences spécifiques;
b) NS5B – polymérase responsable de la multiplication du génome viral. C’est l’enzyme qui lie les nucléotides pour qu’ils forment la chaîne d’ARN viral.
3) La réplication du VHC
[136] La compréhension du cycle de vie du VHC est un aspect important de la découverte d’agents antiviraux, puisque ces médicaments inhibent souvent des fonctions spécifiques du virus qui sont essentielles à sa réplication. Le cycle de vie comporte les étapes illustrées ci‑après :
[137] Ces stades sont les suivants :
a) la particule du VHC se fixe (étape 1) à la cellule hépatique (hépatocyte) hôte et y pénètre (étape 2);
b) une fois à l’intérieur de la cellule, l’enveloppe extérieure du VHC se désagrège pour exposer le brin d’ARN que le virus porte et utilisera pour fabriquer des copies de lui‑même (étapes 3 et 4);
c) le virus utilise les constituants de la cellule hôte pour lire l’information présente dans le brin d’ARN et produire des protéines telles que la NS5B (protéine virale responsable de la fabrication de nouvelles copies du brin d’ARN du VHC, aussi appelée polymérase du VHC) (étape 5);
d) la NS5B reconnaît les nucléotides triphosphate qui se trouvent dans la cellule, s’y fixe et les incorpore au nouveau brin d’ARN (réplication de l’ARN) (étape 6).
[138] Pour synthétiser l’ARN (brin négatif réplicatif ou brin positif de l’ARN viral), il faut des nucléotides triphosphate que la polymérase NS5 ou NS5B utilise pour incorporer les ribonucléotides à la chaîne en croissance du modèle de l’ARN.
K. Les analogues nucléosidiques pour le traitement des infections virales
[139] Quand on met au point des analogues nucléosidiques pour le traitement des infections virales, on doit éviter les effets cytotoxiques. Le but est de tuer le virus, et non la cellule hôte. Ainsi, en 2003, les analogues nucléosidiques ou nucléotidiques à action directe devaient avoir les propriétés suivantes pour être utilisés dans le traitement des infections à VHC :
- pouvoir pénétrer dans les cellules infectées sans leur nuire;
- pouvoir être convertis en nucléotides triphosphates;
- être reconnus sous leur forme triphosphate par la polymérase NS5B du VHC;
- être incorporés au nouveau brin d’ARN du VHC en croissance à la place d’un nucléotide naturel;
- avoir une propriété faisant en sorte que, une fois incorporés au nouveau brin d’ARN du VHC en croissance, ils inhiberont la réplication complète du brin.
L. L’évaluation des traitements contre le VHC
[140] L’étude du VHC et la mise au point des traitements antiviraux se sont heurtées à la difficulté de créer des modèles appropriés, car le VHC est un virus spécifique qui n’infecte que l’humain et les chimpanzés. En 2003, on utilisait plutôt divers modèles in vitro. Il en sera question ci‑après.
1) L’essai de phosphorylation
[141] L’essai de phosphorylation n’est pas utilisé pour mesurer l’activité antivirale directe. Comme je l’ai mentionné, les inhibiteurs nucléosidiques doivent être convertis en leur forme triphosphate in vivo pour être reconnus par une polymérase. L’essai de phosphorylation permet simplement de savoir si un tel inhibiteur peut être phosphorylé in vitro. Pour un tel essai, on se sert de cellules normales non infectées par un virus et, de ce fait, l’essai doit être combiné à d’autres essais pour permettre d’évaluer totalement l’activité antivirale.
2) L’essai sur la polymérase
[142] Comme je l’ai déjà mentionné, un analogue nucléosidique utilisé pour le traitement de l’infection à VHC devrait inhiber l’activité de la NS5B. Le virologue versé dans son art peut se servir de l’essai sur la polymérase du VHC pour évaluer l’activité anti‑VHC (c’est‑à‑dire pour déterminer la capacité de différents composés d’essai à inhiber l’activité de la polymérase du VHC).
[143] Toutefois, l’essai sur la polymérase n’est pas plus idéal que l’essai de phosphorylation. Il exige la production à grande échelle, dans des cellules de bactéries ou d’insectes, d’une polymérase virale soluble. De plus, il ne peut être utilisé que si le composé d’essai est sous sa forme triphosphorylée. Enfin, l’essai sur la polymérase ne renseigne en rien sur la cytotoxicité. En 2003, le virologue versé dans son art aurait été au courant des lacunes de cet essai.
3) Le modèle substitutif VDVB (virus de la diarrhée virale des bovins)
[144] En 2003, il n’existait ni système de culture cellulaire du VHC ni petit modèle animal commode pouvant servir à évaluer les composés anti‑VHC potentiels. Par conséquent, avant que ne soit conçu et adopté l’essai sur réplicon, un certain nombre de scientifiques utilisaient un essai in vitro faisant appel au VDVB, un pestivirus, comme modèle substitutif pour évaluer l’activité anti‑VHC des analogues nucléosidiques.
[145] Des cellules MDBK (cellules de rein de bovin Madin‑Darby) sont d’abord ensemencées sur une monocouche de cellules en culture, puis infectées par le VDVB. Des dilutions en série des composés d’essai sont ensuite ajoutées. Après plusieurs cycles de réplication virale, l’infection initiale donne naissance à des structures visibles appelées plages par suite de la diffusion du virus du site original de l’infection vers de nouveaux sites. Le nombre de plages sur chaque plaque est comparé au nombre de plages présentes sur une plaque témoin à laquelle aucun composé d’essai n’a été ajouté. Si un composé inhibe la réplication de l’ARN du VDVB, il réduit le nombre de plages formées par rapport à la plaque témoin.
4) L’essai sur réplicon
[146] L’essai sur réplicon a été présenté pour la première fois en 1999 par Lohmann et al. dans la prestigieuse revue Science. Un réplicon est une partie du génome du VHC qui peut imiter la réplication de l’ARN du VHC dans les hépatocytes humains. Un système de culture cellulaire de réplicon peut servir à mesurer directement la capacité d’un composé à empêcher la réplication de l’ARN du VSC. Après ajout d’un composé d’essai à la culture cellulaire, les cellules sont incubées pendant une certaine période pour permettre la réplication virale, puis la quantité d’ARN des réplicons dans les cellules est mesurée. En comparant la quantité d’ARN des réplicons dans les cellules exposées au composé d’essai à celle présente dans les cellules témoins, il est possible de quantifier l’effet anti‑VHC du composé d’essai.
5) Les mesures de l’activité antivirale et de la toxicité
[147] Pour être un composé antiviral efficace contre le VHC, un analogue nucléosidique doit agir sélectivement sur le VHC sans être toxique pour les cellules infectées ou non infectées. L’activité antivirale d’un composé s’exprime des façons décrites ci‑après.
[148] La « concentration efficace à 50 % » (CE50) est une mesure de l’activité antivirale d’un composé, c’est‑à‑dire de la quantité du composé requise pour réduire de 50 % le titre, l’ARN ou la protéine du virus dans les cellules infectées. La CE50 est souvent utilisée de façon interchangeable avec la concentration inhibitrice à 50 % (CI50), c’est‑à‑dire la concentration d’un médicament nécessaire pour inhiber 50 % de l’activité de l’ARN polymérase in vitro. En déterminant la quantité du composé d’essai requise pour réduire la réplication virale (c’est‑à‑dire le nombre de plages) de 50 %, il est possible d’établir la CE50 de ce composé. Plus la CE50 est basse, plus le composé est puissant.
[149] La « concentration cytotoxique à 50 % » (CC50) est quant à elle une mesure de la toxicité cellulaire d’un composé. C’est la concentration du composé nécessaire pour réduire de 50 % la numération cellulaire. Plus la CC50 est élevée, moins le composé est toxique.
[150] L’« indice thérapeutique » sert à évaluer les CE50 par rapport aux CC50 à l’aide d’un rapport (CC50:CE50). Étant donné qu’une CC50 élevée indique une faible toxicité et une CE50 basse indique une forte activité antivirale, un composé privilégié afficherait une CC50 nettement supérieure à sa CE50. Un indice thérapeutique élevé est préférable à un indice bas.
[151] Pour établir l’indice thérapeutique, il faut que les CE et les CC soient obtenues avec la même lignée cellulaire que celle dans laquelle le virus a été mis à l’essai. C’est que la sensibilité des lignées cellulaires varie d’un analogue nucléosidique à l’autre.
M. Les promédicaments
[152] Un promédicament est un dérivé biologiquement inactif d’un médicament qui, une fois dans le corps humain, est converti en sa forme active par une voie chimique ou enzymatique. En règle générale, il s’agit d’un composé qui est métabolisé en composé actif à un certain stade in vivo.
[153] La charge négative d’un nucléoside mono‑, di‑ ou triphosphate non masqué, c’est‑à‑dire un nucléotide, fait obstacle à l’absorption cellulaire, empêchant ainsi les médicaments d’atteindre leur cible. Un mono‑, di‑ ou triphosphate à charge négative a de la difficulté à traverser la membrane cellulaire, car la bicouche lipidique de cette membrane résiste aux molécules chargées. Pour surmonter cette difficulté, on peut préparer un promédicament nucléotidique qui masque la charge négative des groupes phosphate afin d’accroître le passage à travers la membrane cellulaire.
[154] Une fois à l’intérieur de la cellule, la portion promédicament du nucléoside ou nucléotide est éliminée. L’élimination peut s’effectuer par clivage du groupe partant en une ou plusieurs étapes au cours du processus de métabolisation. Dans le cas d’un promédicament nucléotidique monophosphate, le nucléotide monophosphate étant déjà à l’intérieur de la cellule, et étant déjà monophosphorylé, il est dans une excellente position pour être converti en ses formes di‑ et triphosphate.
V. La personne versée dans l’art et les connaissances générales courantes
A. La personne versée dans l’art
[155] Le mémoire descriptif du brevet s’adresse à une personne fictive qui possède les compétences et les connaissances usuelles auxquelles le brevet se rapporte et un esprit désireux d’en saisir la teneur (Apotex Inc c Sanofi‑Synthelabo Canada Inc, 2008 CSC 61, au paragraphe 25).
[156] La Cour d’appel fédérale a comparé la personne fictive versée dans l’art à la « personne raisonnable » en droit de la négligence. Ce « monsieur tout‑le‑monde du domaine des brevets » est ainsi décrit dans l’arrêt Beloit Canada Ltd c Valmet OY (1986), 8 CPR (3d) 289, à la page 294 (CAF) :
[L]e technicien versé dans son art, mais qui ne possède aucune étincelle d’esprit inventif ou d’imagination; un parangon de déduction et de dextérité complètement dépourvu d’intuition; un triomphe de l’hémisphère gauche sur le droit.
[157] Ce portrait de la personne versée dans l’art, tel qu’il figure dans l’arrêt Valensi c British Radio Corporation, [1973] RPC 337, à la page 377, m’apparaît également pertinent :
[traduction]
Le destinataire fictif ne possède ni compétence ni connaissance exceptionnelle, et il ne faut pas s’attendre à ce qu’il fasse preuve d’inventivité, ou qu’il se livre à des recherches, à des investigations ou à des expériences approfondies. On peut toutefois s’attendre à ce qu’il montre une maîtrise raisonnable des connaissances courantes dans le domaine lorsqu’il s’agit d’effectuer des essais et de corriger les erreurs évidentes contenues dans le mémoire descriptif, si le moyen de les corriger est évident.
[158] Les compétences de la personne versée dans l’art sont les mêmes, que l’enjeu concerne l’interprétation du brevet, l’utilité et la prédiction valable, le caractère suffisant de la divulgation ou la portée excessive.
[159] Le brevet 191 doit être interprété à la date de sa publication (8 janvier 2004) du point de vue de la personne versée dans l’art.
[160] Les parties conviennent que cette personne peut être une équipe de scientifiques détenant au moins un doctorat et trois ans d’expérience pratique, ou une maîtrise et l’équivalent d’une expérience professionnelle plus importante.
[161] Les parties conviennent aussi dans l’ensemble que cette équipe comprendrait :
a) un chimiste ayant une connaissance ou une expérience des aspects chimiques de la découverte des médicaments, notamment de la synthèse des nucléosides et des techniques de laboratoire standard pour la synthèse et la caractérisation des composés nucléosidiques;
b) un biologiste ou un virologue au fait des aspects biologiques de la découverte des médicaments, particulièrement en ce qui concerne les infections causées par les Flaviviridae et, plus précisément, les infections par le VHC, et possédant une expérience des essais in vitro pertinents, des systèmes de culture cellulaire et de l’interprétation des données de ces essais, des modèles animaux et de l’évaluation de l’activité et de la toxicité dans d’autres modèles d’activité et de toxicité biologiques.
[162] Les experts d’Idenix allèguent que le brevet ne s’adresse pas à la personne versée dans l’art de la pharmacologie possédant des connaissances et une expérience en matière de biodisponibilité, de pharmacocinétique, de délivrance de médicaments et de métabolisme. Ils sont d’avis que le brevet s’adresse aux personnes versées dans l’art de la découverte de nouveaux médicaments dans les deux groupes déjà décrits, par opposition aux personnes dont le travail concerne l’étape suivant la mise au point du médicament — le médicament déjà inventé —, soit celui du pharmacologue.
[163] Je souscris à cette observation et j’accorderai donc moins de poids à certains des éléments de la déposition de M. Krise, notamment en ce qui concerne le sens de l’expression « groupe partant » dans le brevet 191. J’aborde cette question plus loin.
[164] J’accepte en outre l’avis de M. Wnuk selon lequel la personne fictive versée dans l’art pourrait encore avoir besoin de directives et commencerait à peine à effectuer des travaux indépendants, ce qu’a corroboré M. Krise lorsqu’il a déclaré que, bien qu’ils puissent avoir une connaissance approfondie d’un champ d’études très pointu, les jeunes diplômés n’ont qu’une compréhension élémentaire des autres dimensions de ce domaine.
[165] Je partage aussi l’opinion de M. Wnuk selon qui la personne versée dans l’art n’aurait guère d’expérience dans le domaine de la synthèse par fluoration. Selon lui, seul un faible pourcentage de chimistes étaient formés à cet art en 2004. M. Wnuk a pour avantage d’être le seul expert à témoigner qui ait eu une expérience personnelle de la fluoration en 2004.
[166] Je conviens également avec les experts d’Idenix que les personnes versées dans l’art accomplissant les tâches d’un chimiste spécialisé en découverte de médicaments doivent être conscientes de la nécessité de caractériser les composés issus de leurs expériences de synthèse. Ainsi, le chimiste versé dans l’art de la découverte doit employer tous les moyens raisonnables à sa disposition pour caractériser les composés synthétisés. Dans la mesure où l’accès à la technologie peut être limité, ces limites sont attribuables à l’organisation responsable de la découverte de médicaments et ne relèvent pas de la compétence de la personne versée dans l’art.
B. Les connaissances générales courantes
[167] Les connaissances générales courantes sont les « connaissances que possède généralement une personne versée dans l’art en cause au moment considéré », Apotex c Sanofi Synthelabo Canada Inc, [2008] 3 RCS 265, 2008 CSC 61, au point 2 du paragraphe 37 (Plavix (CSC)).
[168] Dans la décision Eli Lilly and Company c Apotex Inc, 2009 CF 991, au paragraphe 97 (Cefaclor), la juge Gauthier a adopté en l’approuvant la description exhaustive des connaissances générales courantes contenue dans l’arrêt General Tire & Rubber Co c Firestone Tyre & Rubber Co Ltd (1971), [1972] RPC 457, aux pages 480 et 481 (C.A. du R.-U.), que j’ai résumée ainsi sans citation :
Il faut prendre soin de distinguer les connaissances générales courantes attribuées au destinataire du brevet de ce que le droit des brevets considère comme des connaissances publiques.
Les connaissances générales courantes sont dérivées d’une détermination rationnelle de ce que saurait effectivement une personne adéquatement versée dans l’art – le genre d’homme, qui fait bien son travail et qui existe réellement.
En règle générale, les mémoires descriptifs de brevets individuels et leur contenu ne font pas partie des connaissances générales courantes, quoiqu’il puisse y avoir des exceptions.
Pour ce qui est des documents scientifiques en général :
• pour établir les connaissances générales courantes, il ne suffit pas de démontrer qu’une divulgation particulière a été faite dans un article, dans une série d’articles ou dans une revue scientifique, quel que soit le tirage de cette revue, en l’absence d’une preuve selon laquelle la divulgation est généralement acceptée par les personnes versées dans l’art auquel elle se rapporte;
• une connaissance précise et divulguée dans un document scientifique ne devient pas une connaissance générale courante simplement parce que le document est lu par de nombreuses personnes, et encore moins parce qu’il a été largement diffusé;
• une telle connaissance ne relèvera des connaissances générales courantes que si elle est généralement considérée comme un bon fondement pour continuer (par opposition à connue de manière générale et acceptée sans hésitation) par ceux versés dans l’art particulier; en d’autres mots, lorsqu’elle fait partie du lot courant des connaissances se rapportant à l’art;
• il est difficile de déterminer comment l’utilisation d’une chose qui, dans les faits, n’a jamais été utilisée dans un art particulier peut être considérée comme une connaissance générale courante de l’art.
[169] La partie qui soutient qu’une information particulière faisait partie des connaissances générales courantes à la date particulière doit l’établir par la preuve.
[170] Idenix invoque la capacité de la personne versée dans l’art de trouver les connaissances générales courantes en se servant des moteurs de recherche couramment utilisés dans le domaine des découvertes et de l’enseignement de la chimie. Elle cite à cet égard cet extrait de la décision de la juge Gauthier dans l’affaire Cefaclor, au paragraphe 104 :
La distinction entre les connaissances générales courantes et les réalisations antérieures qui font partie de l’état de la technique aux fins d’évaluer l’antériorité et l’évidence a tendance à diminuer de nos jours en raison de la complexité des engins de recherche et de l’accessibilité aux publications et aux bases de données électroniques.
[171] Cependant, cela ne signifie pas que l’on peut se servir des articles scientifiques trouvés au moyen de recherches ou autrement produits à l’instruction pour combler les lacunes du brevet 191 en matière de divulgation, à moins d’établir qu’ils remplissent les critères des connaissances générales courantes.
[172] Outre les témoignages d’experts, la Cour a entendu plusieurs personnes qui travaillaient à la synthèse de composés 2’‑C‑Me/F pendant la période pertinente. Je souscris à l’observation de Gilead selon laquelle les données factuelles contemporaines doivent être privilégiées lorsque l’expérience des scientifiques qui se consacrent effectivement au problème diffère de l’opinion théorique des experts.
VI. L’interprétation du brevet 191
A. Les principes d’interprétation
[173] Les revendications du brevet doivent être interprétées avant que la question de sa validité ou de la contrefaçon soit abordée. La règle fondamentale veut que « les revendications reçoivent une seule et même interprétation à toutes les fins » : Whirlpool Corp c Camco Inc, 2000 CSC 67, [2000] 2 RCS 1067, au paragraphe 49 (Whirlpool).
[174] Les principes modernes d’interprétation des revendications ont été élaborés par la Cour suprême du Canada dans les arrêts complémentaires Free World Trust c Électro Santé Inc, [2000] 2 RCS 1024, au paragraphe 13, 2000 CSC 66 (Free World), et Whirlpool. Ces principes ont ultérieurement été résumés ainsi par la Cour fédérale dans Biovail Pharmaceuticals Inc c Canada (Ministre de la Santé nationale et du Bien‑être social), 2005 CF 9, au paragraphe 15 :
1. Un brevet est considéré comme un marché conclu entre l’inventeur et le public. En contrepartie de la divulgation de l’invention, l’inventeur se voit accorder un monopole temporaire lui permettant d’exploiter l’invention pour une période restreinte.
2. La Loi exige que la demande de brevet renferme un mémoire descriptif « définissant distinctement et en des termes explicites l’objet de l’invention dont le demandeur revendique la propriété ou le privilège exclusif ». Le mémoire descriptif doit être rédigé en des termes complets, clairs, concis et exacts « qui permettent à toute personne versée dans l’art ou la science dont relève l’invention, ou dans l’art ou la science qui s’en rapproche le plus, de confectionner, construire, composer ou utiliser l’invention » (Loi sur les brevets, L.R.C. 1985, ch. P‑4, et ses modifications, art. 27).
3. Le brevet s’adresse, en théorie, à une personne versée dans l’art ou la science dont relève l’invention et doit recevoir l’interprétation que cette personne lui aurait donnée lorsqu’il a été rendu public. (Il sera davantage question de cette personne versée dans l’art plus loin dans ces motifs.)
4. Les revendications doivent être interprétées de façon éclairée et en fonction de l’objet pour assurer le respect de l’équité et la prévisibilité, et pour cerner les limites du monopole. « [L]’ingéniosité propre à un brevet ne tient pas à la détermination d’un résultat souhaitable, mais bien à l’enseignement d’un moyen particulier d’y parvenir. La portée des revendications ne peut être extensible au point de permettre au breveté d’exercer un monopole sur tout moyen d’obtenir le résultat souhaité » (Free World Trust, par. 31 et 32).
5. La partie du mémoire descriptif dans laquelle figurent les revendications prévaut sur la partie dans laquelle la divulgation est effectuée, c’est‑à‑dire que l’on se servira de la divulgation pour comprendre le sens d’un mot utilisé dans les revendications « mais non pour élargir ou restreindre la portée de la revendication telle qu’elle [est] écrite et, ainsi, interprétée » (Whirlpool, par. 52).
6. Ce sont seulement les nouvelles caractéristiques que l’inventeur prétend être essentielles qui constituent ce qu’on appelle l’« essence » de la revendication. « L’interprétation téléologique repose donc sur l’identification par la cour, avec l’aide du lecteur versé dans l’art, des mots ou expressions particuliers qui sont utilisés dans les revendications pour décrire ce qui, selon l’inventeur, constituait les éléments essentiels de son invention » (Whirlpool, par. 45).
7. Certains des éléments de l’invention visée par la demande sont essentiels alors que d’autres ne le sont pas compte tenu des connaissances usuelles que détenaient les personnes œuvrant dans le domaine concerné à l’époque où le brevet a été publié ou compte tenu de l’intention de l’inventeur, expresse ou inférée des revendications. Ce point est au cœur de la position de Biovail selon laquelle l’allégation de Novopharm portant qu’elle ne contrefera pas le brevet 320 est fausse. Autrement dit, était‑il manifeste à l’époque de la publication que l’emploi d’une variante ferait une différence?
8. Il est fatal de revendiquer plus que nécessaire. Par ailleurs, si les revendications de l’inventeur sont d’une portée trop limitée, le tribunal ne pourra pas accroître l’étendue du monopole en invoquant « l’esprit de l’invention ». Cela se produit souvent, comme c’est le cas en l’espèce, lorsque l’inventeur recourt à différents niveaux de revendications dont les restrictions sont destinées à servir d’éventuels filets protecteurs de sorte que, si une revendication plus large devait être rejetée, le monopole puisse en partie subsister sur la base d’une autre revendication de moins grande portée.
9. Un brevet n’est toutefois pas un écrit ordinaire. Il est visé par la définition de « règlement » qui figure dans la Loi d’interprétation et il faut l’interpréter de manière compatible avec la réalisation de son objet. « [L]’interprétation des revendications est une question de droit qu’il appartient au juge de trancher, et celui‑ci avait parfaitement le droit de donner aux revendications une interprétation différente de celle préconisée par les parties » (Whirlpool, par. 61).
[175] Les revendications doivent être interprétées de manière téléologique pour « assurer le respect de l’équité et la prévisibilité et pour cerner les limites du monopole » (Dimplex North America Ltd c CFM Corp, 2006 CF 586, 54 CPR (4th) 435, au paragraphe 49, conf. par 2007 CAF 278, 60 CPR (4th) 277 (Dimplex)).
[176] Le brevet doit recevoir une « interprétation téléologique », et non technique ou littérale, compte tenu du contexte global du mémoire descriptif, notamment la divulgation et les revendications telles que les comprendrait la personne versée dans l’art qui lit le brevet afin de comprendre ce que l’inventeur prétend avoir inventé et la portée du monopole qu’il veut obtenir (Free World, aux paragraphes 39, 40, 44 et 50).
[177] Bien que le brevet doive recevoir une interprétation téléologique, la Cour suprême du Canada a déclaré que les concurrents et le public ont droit à des règles claires et précises en ce qui intéresse la portée du monopole accordé. Les éléments discrétionnaires de l’interprétation des revendications (p. ex., l’« esprit de l’invention ») doivent être réduits au minimum, pour n’accorder de protection qu’à l’invention effectivement réalisée de bonne foi. La prévisibilité est assurée en ceci que le breveté est lié par ses revendications; l’équité résulte de l’interprétation éclairée et téléologique de ces revendications (Free World, au paragraphe 43).
B. L’interprétation des revendications du brevet 191
1) La revendication 1
[178] Idenix ne défend ni n’avance d’allégation de contrefaçon à l’égard de la revendication 1. Elle ne s’y réfère que pour définir les substituants des autres revendications qui sont pertinents par rapport à celles‑ci.
[179] Gilead soutient qu’Idenix ne peut pas revenir sur l’observation qu’elle a soumise à l’OPIC et selon laquelle les revendications 1 à 3 forment une seule invention; c’est là ce qu’Idenix a sous‑entendu lorsqu’elle a été priée de restreindre ses revendications pour décrire une demande de brevet ne concernant qu’une seule invention à l’égard de laquelle les revendications 1 à 3 faisaient office de revendications de genre du brevet. Gilead fait valoir que l’invention est donc décrite par les revendications 1 à 3 et celles qui en découlent.
[180] Gilead désire inclure la revendication 1 comme décrivant l’invention, particulièrement parce que la position 2’ (haut) dans cette revendication vise 45 substituants distincts. Dans les revendications 2 et 3, le substituant est un groupe méthyle, le CH3. Tous ces substituants, sauf le méthyle, n’ont jamais été créés ni mis à l’essai, et leur synthèse n’a jamais été divulguée. En l’espèce, Gilead soutient donc à tout bout de champ que l’invention ne peut être prédite, que sa synthèse n’a pas été divulguée, ou que sa portée est excessive.
[181] Je rejette l’observation de Gilead, qui n’est étayée par aucune décision concernant des faits similaires. Je ne vois pas non plus pourquoi Idenix ne peut renoncer à la défense d’une revendication formulée en termes trop larges. Dans l’arrêt Teva Canada Ltd c Pfizer Canada Inc, 2012 CSC 60, [2012] 3 RCS 625 (Viagra), au paragraphe 80, la Cour suprême a jugé cette pratique acceptable :
[80] Je n’attache pas beaucoup d’importance au fait que la revendication 1 vise plus de 260 trillions de composés. La revendication en cascade – même si sa portée peut se révéler exagérée, comme en l’espèce – est courante et ne compromet pas nécessairement le droit du public à la divulgation. Le lecteur versé dans l’art sait que dans ce type de revendication c’est habituellement le composé individuel revendiqué en dernier qui constitue le composé utile. Les revendications de composés non fonctionnels sont simplement réputées invalides. Conformément à l’art. 58, toute revendication valide – en l’occurrence, la revendication 7 – le demeure néanmoins.
[Non souligné dans l’original.]
[182] Par conséquent, la revendication 1 du brevet 191 n’est considérée qu’aux fins de la description de ses substituants tels qu’ils s’appliquent aux revendications 2 et 3. Elle vise un grand nombre d’analogues nucléosidiques (ou de leurs sels pharmaceutiquement acceptables), lesquels sont des composés de formule (IX) dont la structure est la suivante :
a) Les substituants de la revendication 1
(i) Le substituant « X » dans le cycle glucidique
[183] Ce substituant peut être l’oxygène (O), le soufre (S), le SO2 ou le CH2. Il englobe les cycles glucidiques tant naturels (X = O ou CH2) que modifiés (X = S ou SO2). Cependant, dans les revendications 2 et 3, il n’est défini que comme un atome d’oxygène.
(ii) Le substituant « C(Y3)3 » en position 2’ (haut) du cycle glucidique
[184] Ce substituant est un carbone [C] lié à trois atomes [Y3]. Chaque atome Y3 est soit un hydrogène [H] soit un halogène (F, Cl, Br ou I). Les trois atomes Y3 peuvent être semblables ou différents (CF3, CF2Cl, etc.). Selon M. Wnuk, 44 groupes C(Y3)3 représentent ce substituant dans la revendication 1, en plus du groupe méthyle C(H3)3. Le substituant est un groupe méthyle (CH3) dans les revendications 2 et 3.
(iii) Les substituants en position 1’ de la « base »
[185] Le substituant dans la base est répété dans les revendications 2 et 3 et est donc pertinent en l’espèce. Il fait partie d’un vaste éventail de bases puriques et pyrimidiques, naturelles ou non, qui englobe au moins toutes les bases incluses dans la définition des purines et des pyrimidines énumérées à la page 104 du brevet 191. Ces bases sont les suivantes :
[186] Les bases « puriques » ou « pyrimidiques » comprennent notamment l’adénine, les N6‑alkylpurines, les N6‑acylpurines (où l’acyle est un C(O) (un alkyle, un aryle, un alkylaryle ou un arylalkyle), la N6‑benzylpurine, la N6‑halopurine, la N6‑vinylpurine, la purine N6‑acétylénique, la N6‑acylpurine, la N6‑hydroxyalkylpurine, la N6‑alkylaminopurine, la N6‑thioalkylpurine, les N2‑alkylpurines, les N2‑alkyl‑6‑thiopurines, la thymine, la cytosine, la 5‑fluorocytosine, la 5‑méthylcytosine, la 6‑azapyrimidine, y compris la 6‑azacytosine, la 2‑ et/ou 4‑mercaptopyrimidine, l’uracile, la 5‑halouracile, y compris la 5‑fluorouracile, les C5‑alkylpyrimidines, les C5‑benzylpyrimidines, les C5‑halopyrimidines, la C5‑vinylpyrimidine, la pyrimidine C5‑acétylénique, la C5‑acylpyrimidine, la C5‑hydroxyalkylpurine, la C5‑amidopyrimidine, la C5‑cyanopyrimidine, la C5‑iodopyrimidine, la C6‑iodopyrimidine, la C5‑Br‑vinylpyrimidine, la C6‑Br‑vinylpyrimidine, la C5‑nitropyrimidine, la C5‑aminopyrimidine, les N2‑alkylpurines, les N2‑alkyl‑6‑thiopurines, le 5‑azacytidinyle, le 5‑azauracilyle, le triazolopyridinyle, l’imidazolopyridinyle, le pyrrolopyrimidinyle et le pyrazolopyrimidinyle. Les bases puriques comprennent notamment la guanine, l’adénine, l’hypoxanthine, la 2,6‑diaminopurine et la 6‑chloropurine. Les groupes fonctionnels oxygène et azote de cette base peuvent être protégés si on le juge nécessaire ou utile. Les groupes protecteurs qui conviennent étaient bien connus des personnes versées dans l’art. Ce sont le triméthylsilyle, le diméthylhexylsilyle, le t‑butyldiméthylsilyle et le t‑butyldiphénylsilyle, le trityle, les groupes alkyle et les groupes acyle tels que l’acétyle et le propionyle, le méthanesulfonyle et le p‑toluènesulfonyle.
[187] Les experts d’Idenix ont reconnu que les bases visées par cette définition peuvent être liées au cycle glucidique par un atome d’azote (liaison N) ou de carbone (liaison C). Dans tout le brevet, il est fait mention de schémas et de composés comportant des bases non naturelles et la liaison C; aucun ne fonctionnerait avec l’invention, et ces composés seraient en fait fort probablement toxiques en cas d’ingestion par un humain ou un autre hôte.
[188] M. Wnuk estimait qu’une personne versée dans l’art aurait compris que les formules du brevet 191 englobent un grand nombre de bases non naturelles, d’où une énorme quantité de nucléosides.
[189] M. Barrett s’est dit d’avis que, dans le contexte du brevet 191, la personne moyennement versée dans l’art comprendrait que le terme « base » vise les bases puriques ou pyrimidiques pouvant servir au traitement des infections (virales) causées par les Flaviviridae. La classe revendiquée de composés et l’utilisation de ces composés comme agents antiviraux sont l’objet du brevet 191. De même, il estimait que la personne versée dans l’art lisant le brevet 191 comprendrait que les nouvelles modifications aux composés revendiqués ne sont pas apportées à la base, mais plutôt à la position 2’ du cycle glucidique. Ainsi, la personne versée dans l’art saurait que le terme « base » désigne uniquement les bases naturelles.
[190] Cet avis est conforme aux conclusions de la Cour suprême dans l’arrêt Burton Parsons Chemicals c Hewlett‑Packard, [1976] 1 RCS 555, à la page 563 (Burton), et permet d’affirmer que les substituants mentionnés dans le mémoire descriptif dont il paraîtra évident à la personne versée dans l’art qu’ils sont incompatibles avec l’utilisation de l’invention, ne seront pas sélectionnés.
[191] M. Damha a témoigné dans le même sens que M. Barrett. Il a déclaré qu’un nucléoside dont la base porte une liaison C ne serait pas naturel. La personne versée dans l’art comprendrait que les bases comportant une liaison N correspondent normalement aux nucléosides naturels. Pour la personne versée dans l’art, donc, s’il est simplement fait mention d’une « base » ou d’une « base purique ou pyrimidique », il s’agit d’une base à liaison N. Sauf indication contraire, elle comprendrait que les bases sont des bases à liaison N.
[192] Les expressions « bases puriques » et « bases pyrimidiques » sont expressément définies à la page 104 du brevet 191 comme les quatre bases naturelles connues utilisées pour fabriquer l’ARN, à savoir l’adénine (A), la guanine (G), la cytosine (C) et l’uracile (U).
[193] Je comprends que la définition de base figurant dans le brevet désigne un grand nombre de bases naturelles ou non, mais je préfère le témoignage de MM. Barrett et Damha selon lequel la personne versée dans l’art comprendrait que les bases correspondent aux bases à liaison N qui sont utilisées dans le traitement des infections causées par les Flaviviridae, c’est‑à‑dire aux quatre bases naturelles servant à fabriquer l’ARN.
(iv) Les substituants « R1 » et « R2 » en position 5’ (haut) et 3’ (bas) du cycle glucidique
[194] Ces substituants comptent parmi les nombreux substituants expressément énumérés à la revendication 1 du brevet 191. Les nombreux substituants possibles peuvent être classés dans trois grandes catégories : atome (H, par exemple), groupe chimique (phosphate, par exemple) ou groupe de substituants (CO‑alkyle et lipide, par exemple). Cette description des substituants R1 et R2 s’applique aussi à la revendication 2. Elle ne s’applique pas à la revendication 3, où les substituants R1 et R2 sont uniquement un hydroxyle.
2) Le « phosphate » et le « groupe partant pharmaceutiquement acceptable »
[195] Un problème d’interprétation se pose dans la revendication 2 pour ce qui est du terme « phosphate » et de l’expression « groupe partant pharmaceutiquement acceptable ». L’interprétation de ce terme et de cette expression est déterminante pour une partie des questions convenues par les parties au sujet de la l’allégation de contrefaçon d’Idenix. La partie pertinente de la description de ces substituants, plus particulièrement en ce qui concerne leur application à la position 5’ du cycle glucidique, est la suivante :
[traduction]
un phosphate […] ou un groupe partant pharmaceutiquement acceptable qui, administré in vivo, peut fournir un composé où R1 est […] un phosphate
[196] Gilead est en quête d’une interprétation étroite de cet énoncé de façon que le promédicament du sofosbuvir, qui est un phosphoramidate en position 5, ne soit pas visé parce qu’il n’est ni un « phosphate » ni un « groupe partant ». Gilead fait valoir que « phosphate » ne peut se dire que d’un « monophosphate » – PO4. Elle soutient en outre que, par « groupe partant », la personne versée dans l’art entend un groupe clivé en entier, alors que le promédicament utilisé dans le sofosbuvir et Sovaldi est clivé par étapes.
[197] J’estime qu’il vaut mieux aborder la question de l’interprétation de ces termes dans la section sur la contrefaçon, où ils ont une application pratique. Je peux néanmoins dire ici que j’interprète le mot « phosphate » comme comprenant les di‑ et les triphosphates, alors que [traduction] « un groupe partant pharmaceutiquement acceptable qui, administré in vivo, peut fournir un composé où R1 est […] un phosphate » correspond à mon avis aux promédicaments en général, peu importe comment ils sont métabolisés in vivo.
3) La revendication 2
[198] J’ai déjà fait remarquer que la revendication 1 du brevet 191 est pertinente aux fins des descriptions de ses substituants qui s’appliquent aux revendications 2 et 3. La revendication 2 présente la structure suivante :
[199] La revendication 2 vise le composé de la revendication 1 où l’hydrogène est le substituant en position 2’ (haut) du cycle glucidique, ce qui en fait un méthyle, alors que l’oxygène est le seul substituant « X » dans le cycle glucidique, ce qui en fait un furanose. Les autres substituants sont les mêmes. Les conclusions de la Cour quant à l’interprétation des termes « base », « phosphate » et « groupe partant » à propos de la revendication 1 valent aussi pour la revendication 2.
4) La revendication 3
[200] La revendication 3 vise le composé de la revendication 2, sauf que R1 et R2 sont des H, ce qui veut dire que les groupes 3’ et 5’ sont des groupes hydroxyle (OH). Les questions d’interprétation des termes « phosphate » et « groupe partant » ne se posent pas pour cette revendication. Les conclusions de la Cour quant à l’interprétation du terme « base » à propos de la revendication 1 valent aussi pour la revendication 3.
5) Les revendications 4 à 32
[201] Les revendications 4 à 32 visent les composés des revendications 1 à 3. Il est admis qu’elles englobent tous les composés visés par chacune des revendications 1 à 3. Idenix ne défend toutefois aucune revendication, ni ne plaide la contrefaçon de revendications en se fondant sur la revendication 1.
6) Les revendications 4, 5, 17 et 18
[202] Les revendications 4 et 5 visent l’utilisation des composés des revendications 1 à 3 (ou de leurs sels pharmaceutiquement acceptables) pour le traitement d’un hôte infecté par un virus de la famille des Flaviviridae (revendication 4) ou, plus particulièrement, d’un hôte infecté par le VHC (revendication 5). Dans la mesure où ces revendications et d’autres reposent sur la revendication 1, elles ne sont pas valides.
7) Les revendications 6 à 9
[203] Les revendications 6 à 9 (qui dépendent de la revendication 4) visent l’utilisation des composés des revendications 1 à 3 (ou de leurs sels pharmaceutiquement acceptables) en association ou en alternance avec un autre agent antiviral pour le traitement d’un hôte infecté par un virus de la famille des Flaviviridae. La revendication 7 dresse une liste des groupes de ce deuxième agent antiviral, et les revendications 8 et 9 limitent le deuxième agent antiviral aux interférons.
8) Les revendications 10 à 12
[204] Les revendications 10 à 12 (qui dépendent de la revendication 4) visent l’utilisation des composés des revendications 1 à 3 (ou de leurs sels pharmaceutiquement acceptables) pour le traitement d’une infection par un virus de la famille des Flaviviridae, où le composé ou son sel pharmaceutiquement acceptable est sous forme d’[traduction] « unité posologique ».
[205] Par « unité posologique », on entend la quantité définie d’un composé administrée à l’organisme entier (p. ex., humain ou animal). Cette quantité peut être fournie sous forme de comprimé, de capsule, d’injection, de suspension, de sirop, de timbre ou autre.
9) Les revendications 11 et 12
[206] La revendication 11 limite la quantité du principe actif dans l’unité posologique (50 à 1 000 mg). La revendication 12 précise que l’unité posologique doit être un comprimé ou une capsule.
10) La revendication 13
[207] La revendication 13 (qui dépend de la revendication 4) vise l’utilisation des composés des revendications 1 à 3 (ou de leurs sels pharmaceutiquement acceptables) pour le traitement d’un humain infecté par un virus de la famille des Flaviviridae.
11) Les revendications 14 à 16
[208] Les revendications 14 à 16 (qui dépendent de la revendication 4) visent l’utilisation des composés des revendications 1 à 3 (ou de leurs sels pharmaceutiquement acceptables) pour le traitement d’un hôte infecté par un virus de la famille des Flaviviridae, où le composé des revendications 1 à 3 (ou d’un de ses sels pharmaceutiquement acceptables) est sous sa [traduction] « forme essentiellement pure ». Le terme [traduction] « essentiellement » veut dire que, en poids, l’isomère β‑D représente au moins 85 à 90 % du produit (ou d’un de ses sels pharmaceutiquement acceptables), le reste pouvant être constitué d’autres espèces chimiques ou d’énantiomères.
12) Les revendications 15 et 16
[209] Les revendications 15 et 16 visent les utilisations dans lesquelles le composé représente en poids au moins 90 % (revendication 15) ou 95 % (revendication 16) de l’isomère β‑D.
[210] Représenter [traduction] « au moins 90 % » ou [traduction] « au moins 95 % » en poids de l’isomère β‑D signifie que, en poids, au moins 90 % ou 95 % du composé (ou de son sel pharmaceutiquement acceptable) est présent sous forme d’isomère β‑D, le reste pouvant être constitué d’impuretés ou d’autres composés.
13) Les revendications 19 à 32
[211] Les revendications 19 à 32 visent l’utilisation des composés des revendications 1 à 3 (ou de leurs sels pharmaceutiquement acceptables) pour la préparation d’un médicament permettant de traiter un hôte infecté par un virus de la famille des Flaviviridae.
[212] Le terme « médicament » désigne un médicament de formule spécifiée dont l’indice thérapeutique est acceptable.
14) Les revendications 20 à 32
[213] Les revendications 20 à 23 visent la fabrication de médicaments contenant un composé revendiqué avec un ou plusieurs autres agents antiviraux.
[214] La revendication 21 dresse une liste précise des groupes du deuxième antiviral, et les revendications 22 et 23 limitent le deuxième antiviral aux interférons.
[215] Les revendications 24 à 26 visent la fabrication de médicaments contenant un composé revendiqué sous forme d’unité posologique.
[216] La revendication 25 limite la quantité de principe actif dans l’unité posologique (50 à 1 000 mg).
[217] La revendication 26 précise que l’unité posologique doit être un comprimé ou une capsule.
[218] La revendication 27 vise la fabrication d’un médicament où le composé des revendications 1 à 3 (ou un de ses sels pharmaceutiquement acceptables) est sous forme essentiellement pure.
[219] Les revendications 28 et 29 visent la fabrication d’un médicament dans lequel le composé représente en poids au moins 90 % (revendication 28) ou au moins 95 % de l’isomère β‑D (revendication 29).
[220] La revendication 32 vise l’utilisation des composés des revendications 1 à 3 pour la fabrication d’un médicament destiné au traitement d’un hôte infecté par le VHC.
VII. L’utilité
A. Les principes généraux
1) L’exigence d’utilité
[221] Il est convenu qu’il n’y avait pas d’utilité démontrée en date du 27 juin 2003. Idenix a admis n’avoir mis à l’essai aucun des composés relevant des revendications du brevet 191 avant mars 2005. Par conséquent, le seul argument permettant d’établir l’utilité des composés 2’‑C‑Me/F repose sur une prédiction valable issue de la mise à l’essai des composés 2’‑C‑Me/OH.
[222] Gilead allègue que le brevet 191 est invalide parce qu’à la date du dépôt, soit le 27 juin 2003, Idenix n’avait pas valablement prédit l’utilité promise.
[223] L’article 2 de la Loi sur les brevets définit l’invention comme « [t]oute réalisation, tout procédé, toute machine, fabrication ou composition de matières, ainsi que tout perfectionnement de l’un d’eux, présentant le caractère de la nouveauté et de l’utilité ».
[224] La Cour suprême du Canada a récemment résumé dans l’arrêt Viagra, aux paragraphes 37 à 40, un grand nombre des critères requis pour établir que l’invention est « utile » ou qu’elle présente une « utilité » :
• pour satisfaire à la condition d’utilité prévue à l’article 2, il suffit que l’invention exposée fasse ce qu’elle est censée faire selon le brevet, c’est‑à‑dire qu’elle tienne sa promesse;
• lorsque l’utilité d’une invention ne peut être effectivement démontrée par voie d’essais ou d’expériences, son utilité peut néanmoins être établie au moyen d’une prédiction valable;
• le défaut de divulguer des informations sur les composés mis à l’essai intéresse la divulgation de l’invention, et non son utilité;
• l’invention doit être utile à la date de la revendication (27 juin 2013) au vu des informations et de l’expertise alors disponibles;
• si un brevet qu’on a voulu faire reposer sur une prédiction valable est ensuite contesté, la contestation réussira si la prédiction n’était pas valable à la date de la demande ou si, indépendamment de son caractère valable, l’absence d’utilité est établie à l’égard d’une partie du domaine visé.
[225] Lorsque le mémoire descriptif ne promet pas de résultat spécifique, aucun degré particulier d’utilité n’est requis; la « moindre parcelle » d’utilité suffira. Cependant, si le mémoire énonce une « promesse » explicite, l’utilité sera mesurée au regard de cette promesse : Consolboard Inc c MacMilan Bloedel (Saskatchewan Limited), [1981] 1 RCS 504, à la page 525 (Consolboard); Pfizer Canada Inc c Canada (Ministre de la Santé), 2008 CAF 108, [2009] 1 RCF 53. La question est de savoir si l’invention fait ce que promet le brevet.
[226] Avant de se demander si les inventeurs avaient démontré l’utilité, la Cour doit examiner ce que l’invention est censée faire d’après le mémoire descriptif. Les revendications en cause doivent être interprétées et examinées à la lumière du mémoire descriptif du point de vue de la personne versée dans l’art, par rapport à l’état d’avancement de la science et aux données disponibles au moment du dépôt du brevet : Apotex Inc c Wellcome Foundation Ltd, 2002 CSC 77, [2002] 4 RCS 153 (Wellcome/AZT), au paragraphe 51; Consolboard, précité, à la page 521; Free World, précité, au paragraphe 44; Eli Lilly Canada Inc c Novopharm Ltd, 2010 CAF 197, au paragraphe 80 (Eli Lilly/Zyprexa).
[227] La question de savoir si le brevet contient une promesse d’utilité doit constituer la première étape de l’analyse relative à l’utilité. Comme la doctrine de la promesse soumet l’inventeur à une norme élevée, celle‑ci s’appliquera uniquement lorsque la promesse a été faite de façon claire et non ambigüe. Lorsque la validité d’un brevet est contestée au motif que la promesse n’a pas été respectée, le brevet sera interprété en faveur du titulaire du brevet lorsque la personne versée dans l’art pourrait raisonnablement comprendre que le brevet ne contient pas cette promesse : Apotex Inc c Pfizer Canada Inc, 2014 CAF 250, au paragraphe 66.
2) La promesse du brevet 191
a) Les composés à l’égard desquels l’utilité est revendiquée
[228] Gilead affirme que l’utilité énoncée du brevet 191 se rapporte à tous les composés revendiqués, ce qui inclut selon elle ceux qui relèvent de la revendication 1. Dans cette optique, elle a produit des témoignages d’expert selon lesquels la description du brevet 191 serait invalide, puisqu’elle ne précise pas quel composé a une activité antivirale ni contre quel virus de la famille des Flaviviridae.
[229] Comme je l’ai mentionné, je conclus que les composés visés par la revendication 1 ne sont pas en litige. Les composés pertinents sont donc les nucléosides 2’‑C‑Me/F des revendications 2 et 3 et leurs nucléotides et autres dérivés. À mes yeux, ces composés sont suffisamment caractérisés du point de vue de leur utilité. C’est le cycle glucidique du 2’‑C‑Me/F qui constitue le fondement du brevet 191 et qui est reconnu par les deux parties comme étant responsable de son effet antiviral, tout comme le cycle glucidique du brevet 657.
[230] Il suffit que l’utilité soit démontrée ou valablement prédite relativement à un nucléoside du brevet 191 pour qu’il soit satisfait aux exigences de la Loi.
b) L’utilité énoncée
[231] Une fois les composés limités au genre décrit dans les revendications 2 et 3, la promesse du brevet 191 n’est plus une question indûment litigieuse. L’utilité n’est à considérer que pour les revendications en litige à la lumière du mémoire descriptif. Gilead et Idenix conviennent que le brevet promet l’utilité des composés dans le traitement des infections causées par les Flaviviridae, y compris les infections par le VHC, chez l’humain et les autres hôtes.
[232] M. Seeger, qui a témoigné pour le compte de Gilead sur cette question, a extrait de nombreux énoncés du brevet 191, se disant d’avis que les composés revendiqués étaient tous déclarés utiles au traitement des infections causées par les Flaviviridae, y compris les infections par le VHC, chez l’humain et les autres hôtes.
[233] La mention principale figure dans la clause concernant les objets du brevet, en page 12 :
[traduction]
Par ailleurs, à cause de la menace grandissante que posent d’autres infections par les Flaviviridae, un net besoin se fait sentir de procurer de nouveaux agents pharmaceutiques efficaces et faiblement toxiques pour l’hôte.
C’est donc un objet de la présente invention que de procurer un composé, une méthode et une composition pour le traitement d’un hôte infecté par le virus de l’hépatite C.
Un autre objet de la présente invention est de présenter une méthode et une composition générales pour le traitement des patients infectés par un pestivirus, un flavivirus ou un hepacivirus.
[234] Ces promesses sont étayées par des mentions similaires ailleurs dans le mémoire descriptif et les revendications répétant ces promesses, notamment dans les sections [traduction] « Domaine de l’invention », à la page 1; [traduction] « Résumé de l’invention », à la page 12; [traduction] « Description détaillée de l’invention », aux pages 21 et 22; [traduction] « Caractéristiques de l’invention », aux pages 23 à 28; [traduction] « Composés actifs », à la page 100; et [traduction] « Composition pharmaceutique », à la page 117. Les promesses sont aussi répétées dans les revendications du brevet 191, par exemple dans la revendication 4 en ce qui concerne [traduction] « [l]’utilisation d’une quantité thérapeutiquement efficace d’un composé visé par l’une des revendications 1 à 3 (maintenant considérées comme les revendications 2 et 3), ou d’un de ses sels pharmaceutiquement acceptables, pour le traitement d’un hôte infecté par un virus de la famille des Flaviviridae », et dans les revendications connexes.
[235] M. Seeger n’a pas été contredit par Idenix. M. Lamarre, le seul témoin qui soit intervenu pour son compte au chapitre de l’utilité, a déclaré ce qui suit au paragraphe 69 de son rapport :
[traduction]
[69] En ce qui concerne l’utilité de l’invention revendiquée, M. Seeger et moi convenons que les composés revendiqués, ou leurs sels ou promédicaments pharmaceutiquement acceptables, sont utiles dans le traitement des infections causées par les Flaviviridae, y compris les infections par le VHC, chez l’humain et les autres hôtes.
c) La toxicité
[236] L’argument d’Idenix selon lequel le brevet 191 ne renferme aucune promesse d’absence de toxicité m’apparaît excessif. Je cite à cet égard le paragraphe 188 de ses observations écrites :
[traduction]
[188] Enfin, rien dans les revendications ou la description du brevet 191 (ni au demeurant dans les témoignages d’expert de l’une ou l’autre des parties) n’évoque une promesse que les composés revendiqués sont non toxiques, ont des effets secondaires réduits ou répondraient nécessairement aux normes d’homologation cliniques ou réglementaires.
[Non souligné dans l’original.]
[237] Je souscrirais à cette observation à l’égard de toute promesse concernant une réduction des effets secondaires ou le respect nécessaire des normes d’homologation cliniques ou réglementaires. Par exemple, dans la décision Eli Lilly Canada Inc c Mylan, 2015 CF 17, aux paragraphes 87 à 92, la Cour a conclu que les mentions de la toxicité ne comprenaient pas les effets secondaires observés durant les essais cliniques.
[238] Là où je suis en désaccord avec Idenix, si c’est là la position qu’elle défend, c’est sur le fait que le brevet, dans sa démonstration de l’activité antivirale, ne promet nullement de démontrer l’existence d’un indice thérapeutique satisfaisant. À noter que cet indice sert à évaluer l’activité antivirale d’un composé par rapport à sa toxicité pour la cellule. M. Lamarre a déclaré en contre‑interrogatoire que l’activité antivirale qui s’accompagne d’une toxicité n’est pas utile (page 3264), et le professeur La Colla a affirmé que [traduction] « pour un composé antiviral, on voudra inhiber la multiplication du virus sans tuer la cellule ».
[239] De même, M. Seeger a déclaré ce qui suit au cours de son témoignage :
[traduction]
Un composé antiviral efficace doit avoir une activité sélective contre le virus et être non toxique pour les cellules infectées ou non par le virus. Un composé n’est pas utile au traitement d’une infection virale s’il est aussi plus particulièrement toxique pour l’hôte. Le virologue versé dans son art ne jugerait pas un composé utile au traitement contre les Flaviviridae s’il présentait une forte cytotoxicité.
[240] À mon avis, le chimiste versé dans son art estimerait que le traitement d’un hôte infecté par le VHC doit être à la fois efficace et faiblement toxique, ces éléments étant déterminés par son indice thérapeutique.
d) Le degré d’utilité et la manière dont celle‑ci est démontrée ou prédite
[241] J’estime que le brevet 191 ne promet ni un résultat ni un degré de traitement précis. Je conclus donc que, pour que ses arguments soient retenus, Gilead doit prouver qu’Idenix n’a pas démontré ni valablement prédit la moindre parcelle d’utilité des composés 2’‑C‑Me/F dans le traitement contre les Flaviviridae.
[242] Cependant, je ne souscris pas à l’une des observations d’Idenix concernant la manière dont la personne versée dans l’art détermine qu’une parcelle d’utilité est démontrée ou prédite. Idenix avance un argument fondé sur l’avis exprimé par M. Lamarre dans son rapport de novembre sous la rubrique [traduction] « Comment une personne versée dans l’art peut‑elle mesurer l’utilité de l’invention? », qui s’achève au paragraphe 86 par la déclaration suivante :
[traduction]
Bref, à la lecture du brevet 191, le biochimiste versé dans son art comprendrait qu’un composé est utile contre les Flaviviridae s’il peut présenter un effet antiviral positif dans au moins un essai contre au moins un virus de la famille des Flaviviridae.
[Non souligné dans l’original.]
[243] M. Lamarre semble aborder ici un certain nombre de questions. Tout d’abord, il semble affirmer que les termes d’un brevet déterminent la manière dont l’utilité doit être démontrée, dans le cadre de sa promesse, apparemment. Ensuite, il déclare qu’un essai contre un virus d’un certain type (le VHB, par exemple) de la famille des Flaviviridae suffit à démontrer l’utilité contre tous les autres virus du même type et contre tous les virus des deux autres types (VHA et VHC) composant cette famille.
[244] Je délaisse pour l’instant la question de cet essai permettant de démontrer l’utilité contre tous les Flaviviridae jusqu’à ce que les allégations de prédiction valable d’Idenix aient été analysées. Idenix doit pouvoir établir que la prédiction valable a un fondement factuel pour pouvoir valablement prédire l’utilité des composés 2’‑C‑Me/F d’après les essais du composé 2’‑C‑Me/OH.
[245] Pour revenir à la question de la promesse du brevet, et pour ce qui est de déterminer ce qui constitue une preuve suffisante pour établir une parcelle d’utilité, il semblerait que M. Lamarre essaye de compenser la rareté des données d’analyse dans le brevet 191. D’après lui, revendiquer les données issues d’un seul essai suffit à démontrer l’utilité suivant l’interprétation du brevet par la personne versée dans l’art.
[246] Je conviens avec Gilead que le brevet 191 ne peut se prêter à une telle interprétation. Ce qui est plus est pertinent, cependant, c’est que le caractère suffisant de la preuve visant à établir l’utilité ne dépend pas des revendications ou des promesses contenues dans le brevet, mais de la validité du fondement factuel, en l’espèce celui de la prédiction et du caractère raisonnable du raisonnement qui l’étaye.
[247] J’estime par ailleurs que cette position vise à contrer la rareté des données d’essai concernant les composés 2’‑C‑Me/OH dans le brevet. Cela n’est pertinent que si Idenix est tenue de divulguer le fondement de la prédiction valable dans le brevet. Cette dernière affirme qu’elle n’est pas obligée de le faire. Par ailleurs, Idenix a en sa possession de nombreux éléments de preuve selon lesquels elle a procédé à des essais poussés et variés de ses nucléosides 2’‑C‑Me/OH lui permettant de faire valoir que ces résultats devraient s’appliquer à toute la famille des Flaviviridae.
3) La prédiction valable
a) Les principes généraux
[248] L’inventeur peut invoquer la doctrine de la prédiction valable pour justifier les revendications du brevet dont l’utilité n’a pas réellement été démontrée, le plus souvent parce que l’invention n’a pas été réalisée, mais qu’elle peut être valablement prédite eu égard aux informations et à l’expertise disponibles. Si un brevet qu’on a tenté d’étayer par une prédiction valable est par la suite contesté, la contestation réussira si, comme l’a affirmé le juge Pigeon dans l’arrêt Monsanto Co c Commissaire des brevets, 1979 CanLII 244 (CSC), [1979] 2 RCS 1108, à la page 1117, la prédiction n’était pas valable à la date de la demande ou si, indépendamment du caractère valable de la prédiction, « [i]l y a preuve de l’inutilité d’une partie du domaine visé » (Wellcome/AZT, au paragraphe 56).
[249] Pour établir si l’inventeur a fait une prédiction valable, la Cour suprême du Canada a énoncé ce critère en trois volets dans l’arrêt Wellcome/AZT, au paragraphe 70 (non souligné dans l’original) :
1. la prédiction doit avoir un fondement factuel;
2. l’inventeur doit avoir un raisonnement clair et « valable » qui permette d’inférer du fondement factuel le résultat souhaité;
3. il doit y avoir divulgation suffisante (ce que conteste Idenix).
[250] Le fardeau de la preuve incombe également à la partie qui conteste le brevet pour manque d’utilité. Cependant, comme les documents et les renseignements pertinents sont généralement ou souvent en la possession ou sous le contrôle du titulaire de brevet, le contestataire peut s’acquitter de son fardeau en produisant une preuve d’expert relativement aux questions pertinentes : Bell Helicopter Textron Canada Limitée c Eurocopter, 2013 CAF 219, aux paragraphes 154, 161 et 162.
b) La norme applicable en matière de prédiction valable
[251] Idenix cite l’arrêt de la Cour d’appel fédérale dans l’affaire Eli Lilly/Zyprexa, précité, au paragraphe 76, et la décision de la Cour dans l’affaire AstraZeneca Canada Inc c Apotex Inc, 2014 CF 638, au paragraphe 182 (AstraZeneca/Pregabalin), selon lesquels la norme appropriée en matière de prédiction valable est une « inférence prima facie raisonnable ». Dans la deuxième affaire, la Cour a déclaré que « [c]ette inférence prima facie raisonnable se situe entre la simple spéculation et la certitude, voilà l’indication la plus claire quant à l’approche indiquée en l’espèce ».
c) La prédiction valable est un fait inféré qui n’est pas prouvé en l’espèce
[252] Comme je l’ai déjà noté, la Cour suprême a déclaré aux paragraphes 70 et 71 de l’arrêt Wellcome/AZT qu’une prédiction valable est un fait (« il vaut la peine de répéter que la question de savoir si la prédiction est valable est une question de fait) inféré (raisonnement « valable » permettant d’inférer le résultat souhaité à partir du fondement factuel).
[253] Le fait inféré prédit qui, selon Idenix, découle de ses faits essentiels basés sur l’activité antivirale démontrée des composés 2’‑C‑Me/OH et d’un raisonnement valable est qu’en 2003, la personne versée dans l’art pouvait valablement prédire que, lorsqu’il serait synthétisé, le nucléoside 2’‑C‑Me/F présenterait une activité antivirale thérapeutique similaire à celle de son composé 2’‑C‑Me/OH.
[254] Il est convenu que, pour démontrer un fait, la preuve doit l’établir selon la norme de la prépondérance des probabilités, généralement décrite comme une vraisemblance ou une probabilité. Tout fait situé en deçà de cette norme de preuve n’est pas établi. Tout ce qui n’est pas établi selon la prépondérance des probabilités à partir de la preuve n’est qu’une simple possibilité, ou s’il s’agit d’inférences, qu’une simple conjecture.
[255] Ainsi que la Cour l’analyse ci‑dessous, je conclus qu’Idenix n’a pas établi selon la prépondérance des probabilités, au moyen des éléments de preuve pertinents présentés à la Cour, que les chimistes versés dans l’art pouvaient valablement prédire, à la date du dépôt de la demande de brevet 191, une activité antivirale du nucléoside 2’‑C‑Me/F avant sa synthèse. Par conséquent, je tire la conclusion de fait suivante : le brevet 191 est invalide pour manque d’utilité, démontrée ou valablement prédite.
B. L’allégation de prédiction valable avancée par Idenix
1) Aperçu
[256] En résumé, Idenix allègue que la prédiction valable des inventeurs reposait sur les trois éléments suivants :
1. de vastes connaissances concernant l’activité antivirale des analogues nucléosidiques 2’‑C‑Me/OH;
2. une activité attendue des analogues nucléosidiques 2’‑C‑Me/OH contre la famille des Flaviviridae parce que ces virus ont :
a. une structure génomique similaire,
b. des motifs de séquence et des motifs structuraux conservés,
c. un mécanisme d’action conservé pour ce qui est de leur ARN polymérase (NS5 et NS5B), et parce qu’
d. il existait des modèles prédictifs substitutifs et représentatifs connus des Flaviviridae;
3. une acceptation générale dans le domaine des nucléosides que le fluor est un isostère du groupe hydroxyle.
[257] Les points 1 et 2 constituent le premier fondement factuel permettant d’établir que les nucléosides 2’‑C‑Me/OH présentent une activité contre le VHC. Cette conclusion s’avère aussi une forme de prédiction dans la mesure où les données d’essai d’Idenix concernant ses composés 2’‑C‑Me/OH, les essais sur les chimpanzés mis à part, portent sur les flavivirus et les pestivirus, et non pas sur le VHC à l’aide des essais sur réplicon alors disponibles. L’argument d’Idenix est que ses essais d’activité contre les flavivirus et les pestivirus n’en sont pas moins des essais substitutifs pour prédire l’efficacité contre le VHC. Idenix s’appuie sur les publications pour étayer sa conclusion que le composé 2’‑C‑Me/OH a été mis à l’essai contre l’ensemble des virus de la famille des Flaviviridae, y compris au moyen d’essais sur réplicon. Elle s’appuie aussi sur ses données relatives aux chimpanzés, lesquels sont équivalents de la lignée cellulaire humaine.
[258] Idenix soutient que le point 3 constitue le fondement factuel du raisonnement valable permettant de prédire l’activité antivirale des nucléosides 2’‑C‑Me/F d’après celle démontrée par les nucléosides 2’‑C‑Me/OH. Elle fait valoir que la similitude des structures stéréochimiques du fluor et du groupe hydroxyle en tant qu’isostères implique que le remplacement du groupe hydroxyle par un fluor dans le nucléoside 2’‑C‑Me/OH entraînerait probablement une certaine activité antivirale dans le nucléoside 2’‑C‑Me/F, puisque le fluor « imite » l’hydroxyle.
[259] Dans mon analyse ci‑après, je considérerai d’abord les faits relatifs au nucléoside 2’‑C‑Me/OH tels qu’ils sont décrits dans les observations d’Idenix aux points 1 et 2 ci‑dessus. J’estime que le fondement factuel est satisfaisant et me permet de conclure qu’en 2003, les nucléosides 2’‑C‑Me/OH démontraient une activité antivirale thérapeutique contre le VHC.
[260] Mon analyse plus détaillée porte sur le point 3, qui concerne le fondement factuel et le raisonnement valable permettant de valablement prédire l’activité antivirale des nucléosides 2’‑C‑Me/F d’après celle des nucléosides 2’‑C‑Me/OH. Je conclus que Gilead s’est acquittée de son obligation de démontrer que la prédiction valable d’utilité du nucléoside 2’‑C‑Me/F est une simple possibilité et relève de la spéculation.
[261] Afin de tirer des conclusions de fait qui pourraient s’avérer pertinentes si la présente affaire devait être portée en appel, je compléterai mon analyse en me demandant si Gilead a démontré qu’Idenix est tenue de divulguer suffisamment la prédiction valable de l’utilité des composés 2’‑C‑Me/F dans le brevet 191 et, en l’admettant, si la première a démontré que la seconde ne l’a pas fait. Je conclus qu’Idenix n’est pas tenue de divulguer le fondement de sa prédiction valable, mais que, si tel avait été le cas, le brevet 191 ne satisferait pas à cette exigence.
2) Analyse de la prédiction d’activité d’Idenix contre toute la famille des Flaviviridae (points 1 et 2)
a) De vastes connaissances concernant l’activité antivirale
[262] Comme je l’ai mentionné, je suis prêt à accepter les points 1 et 2 des observations d’Idenix plus haut selon lesquelles il existait un fondement factuel permettant de prédire l’activité antivirale des nucléosides 2’‑C‑Me/OH contre toute la famille des Flaviviridae. Pour ce qui est du point 1, je conclus qu’Idenix, à titre d’inventeur de l’utilisation du nucléoside 2’‑C‑Me/OH comme composé antiviral, avait travaillé à cette invention pendant environ quatre ans au moment de la demande. Elle avait acquis des connaissances considérables au sujet de l’activité antivirale de ce composé. Je ne crois pas que cette affirmation soit sérieusement contestée par Gilead.
[263] Le professeur La Colla a commencé à mettre à l’essai un composé d’adénine en juillet 1999. Par la suite, il a fait l’essai d’octobre 2000 à mai 2001 d’un certain nombre de nucléosides 2’‑C‑Me/OH avec différentes bases, dont les trois autres bases naturelles (cytosine, guanine et uracile).
[264] La demande WO 01/90121 (Novirio 121), publiée le 29 novembre 2001, revendiquait les structures 2’‑C‑Me/OH pour leur activité contre le VHC avec les quatre bases naturelles (adénine, cytosine, guanine et uracile). La demande WO 01/92282 (Novirio 282), publiée le 6 décembre 2001, divulguait les structures 2’‑C‑Me/OH pour leur activité contre les flavivirus et les pestivirus.
b) Une activité attendue des analogues nucléosidiques 2’‑C‑Me/OH contre la famille des Flaviviridae
[265] En ce qui a trait au point 2 plus haut, je ne crois pas que les points 2 a), b) et c) prêtent à controverse lorsqu’il est dit que les virus de la famille des Flaviviridae présentent une structure génomique similaire, des motifs de séquence et des motifs structuraux conservés et des mécanismes d’action conservés pour ce qui est de leur ARN polymérase (NS5 et NS5B). Le témoignage du M. Damha sur ce point n’a pas été sérieusement contesté.
[266] Seul le point 2 d) selon lequel il existait des modèles prédictifs substitutifs et représentatifs connus des Flaviviridae est contesté. Cette contestation a surtout à voir avec le défaut d’Idenix de soumettre les nucléosides 2’‑C‑Me/OH à des essais sur réplicon. Ces essais sont réalisés directement sur la lignée cellulaire du VHC.
[267] Idenix a plutôt procédé à ces essais à l’aide de modèles imitant le VHC, ou modèles substitutifs. Les essais substitutifs effectués par Idenix portaient sur le VDVB, le virus de la fièvre jaune, le virus du Nil occidental et le virus de la dengue. Les modèles sont décrits comme substitutifs parce que les essais ne sont pas réalisés sur des lignées cellulaires du VHC, de telles lignées n’existant que pour l’humain et les chimpanzés.
[268] Je conclus que les essais menés par Idenix et déclarés par d’autres dans la documentation connue de cette société étayent la conclusion que les inventeurs s’attendaient raisonnablement à une activité antivirale du nucléoside 2’‑C‑Me/OH contre l’ensemble des virus de la famille des Flaviviridae.
(i) Les données relatives aux chimpanzés
[269] Idenix a mis à l’essai son nucléoside NM283, ou adénosine 2’‑C‑Me/OH, sur des chimpanzés, cette espèce étant la plus analogue à l’humain. Elle a souligné que la Food and Drug Administration (FDA) des États‑Unis l’avait autorisée à mener chez l’humain des essais cliniques de nouveau médicament expérimental avec le nucléoside 2’‑C‑Me/OH (adénosine NM107/NM283) en décembre 2002, autorisation qui, selon elle, n’aurait jamais été donnée si la FDA n’avait pas été satisfaite des données d’essai d’Idenix. Aucune donnée d’essai sur réplicon n’avait été exigée avant que ces essais ne soient autorisés. M. Seeger a convenu que l’autorisation était probablement fondée sur les données d’essai relatives aux chimpanzés.
(ii) L’article de Carroll et al.
[270] De plus, Idenix s’appuie sur une étude publiée en janvier 2003 dans The Journal of Biological Chemistry par Steven Carroll et d’autres scientifiques de Merck et décrivant les données d’essais indépendants réalisés à l’aide du composé d’adénine 2’‑C‑Me/OH d’Idenix. J’accepte l’observation d’Idenix selon laquelle cet article est important parce qu’il confirme l’activité thérapeutique des composés d’Idenix et de leurs promédicaments, y compris le mécanisme d’action qu’est la terminaison de chaîne, contre toute la famille des Flaviviridae d’après les séquences critiques conservées de leur ARN polymérase ARN dépendante.
[271] Dans ses conclusions, Merck renvoie à des essais comparatifs, y compris à des essais sur réplicon du VHC. Ces essais confirment l’activité antivirale à des concentrations semblables à celles qu’a obtenues le professeur La Colla dans ses essais cellulaires substitutifs. J’estime que ces résultats invalident largement la thèse de Gilead au sujet de l’absence d’essais sur réplicon permettant d’étayer la prédiction valable d’Idenix.
[272] Gilead s’est opposée à ce que le professeur La Colla témoigne au sujet de cet article, qui n’était pas mentionné dans le brevet 191; elle a fait valoir qu’elle apprenait pour la première fois que ce dernier l’invoquait. Le professeur La Colla prétend avoir été informé de l’article par un courriel ayant circulé parmi les membres du personnel d’Idenix chargé des découvertes. Le courriel en question n’a jamais été produit en preuve. Le professeur La Colla reconnaît que personne n’a réclamé ses documents et donc qu’aucun n’a été produit.
[273] Après avoir entendu des arguments sur ce point, j’ai déclaré que j’autoriserais l’examen du document, mais que je devais évaluer le poids à accorder à la déclaration du professeur La Colla selon laquelle il se souvenait d’avoir reçu l’article et d’avoir été [traduction] « ravi » parce qu’il confirmait sa prédiction que les composés 2’‑C‑Me/OH se révéleraient avoir une activité antivirale.
[274] Il est difficile de concevoir qu’un article d’une telle importance n’ait pas été mentionné dans le brevet 191. Cela donne à penser qu’aucun des inventeurs ne connaissait son existence. Le fait qu’aucun des documents détenus par professeur La Colla n’ait été produit est également préoccupant.
[275] Il est fort possible, néanmoins, que des documents connus des inventeurs n’aient pas trouvé place dans le brevet. Je ne pense pas que le professeur La Colla induirait intentionnellement la Cour en erreur. L’article, qui a été examiné par des pairs et publié dans une revue scientifique bien connue, aurait dû être d’un grand intérêt pour Idenix. C’est le genre de document qui serait distribué à tous les membres de l’équipe chargée des découvertes, eu égard à sa pertinence et au fait qu’il corrobore leurs travaux. De plus, dans les circonstances, le professeur La Colla aurait dû être un destinataire prioritaire compte tenu du rôle important qu’il a joué dans les essais portant sur les composés d’Idenix, dont la validation était justement l’objet de l’article de Carroll.
(iii) Les études d’Eldrup et al., de Bhat et al. et d’Olsen et al.
[276] Le brevet 191 renvoyait à trois études dont il a été question lors de séances de discussion sur les Flaviviridae et le VHC à la 16e conférence internationale sur la recherche antivirale (27 avril 2003 à Savannah, en Géorgie). Il s’agissait 1) de l’étude d’Eldrup et al. décrivant la relation structure‑activité des nucléosides modifiés en position 2’ pour ce qui est de l’inhibition du VHC, 2) de l’étude de Bhat et al. décrivant la synthèse et les propriétés pharmacocinétiques des analogues nucléosidiques en tant qu’inhibiteurs possibles de la réplication de l’ARN du VHC et 3) de l’étude d’Olsen et al. décrivant les effets des nucléosides modifiés en position 2’ sur la réplication de l’ARN du VHC. Ces auteurs ont signalé que les nucléosides modifiés en position 2’ présentaient une activité inhibitrice dans les essais cellulaires sur réplicon. Ces références concernent uniquement les résumés publiés des exposés à la conférence de Savannah. Toutefois, M. Storer et d’autres représentants d’Idenix ont assisté aux exposés et produit des rapports à leur sujet. Ces études étaient donc assurément connues des inventeurs.
c) Les observations de Gilead
[277] J’admets le témoignage de M. Seeger selon lequel, sans les données d’essai sur réplicon, il n’y aurait normalement pas eu de fondement suffisant pour prédire valablement l’activité contre tous les Flaviviridae d’après les données d’essais du nucléoside 2’‑C‑Me/OH. Les données déposées en preuve sur l’évolution de la technologie des essais me convainquent que l’arrivée en 1999 de l’essai sur réplicon a immédiatement été reconnu comme une importante percée dans les connaissances générales courantes du virologue versé dans son art qui l’a incité à mener des essais sur le VHC.
[278] Les inventeurs qui ont déposé des demandes de brevet pour des antiviraux destinés à lutter contre les Flaviviridae au début du XXe siècle ont invariablement adopté l’essai sur réplicon pour valider leurs conclusions. On peut notamment mentionner à ce sujet les demandes de M. Damha déposées pendant cette période et la plupart des brevets dont ont parlé les témoins tout au long de l’instance pour la période visée. Les essais sur réplicon étaient clairement une exigence pour valider l’utilité contre le VHC au moment du dépôt du brevet 191.
[279] En ce qui a trait aux autres critiques de Gilead, j’accepte l’affirmation de M. Seeger selon laquelle Idenix a concentré ses efforts sur certains nucléosides, s’interrogeant dans une certaine mesure sur ces limites. Je ne vois cependant pas en quoi cela influerait sur la fiabilité ou la validation de ses données ayant servi de fondement à la prédiction d’utilité, dans la mesure où la prédiction valable repose sur l’activité antivirale des nucléosides 2’‑C‑Me/OH. Je conclus également que les essais d’Idenix viennent contrer l’argument de M. Seeger selon lequel les auteurs des publications reconnaissaient que les analogues nucléosidiques ne sont pas tous nécessairement actifs ou, s’ils le sont, que leur puissance diffère d’un virus de la famille des Flaviviridae à l’autre.
[280] La prédiction valable d’Idenix porte avant tout sur la similitude de l’activité antivirale en position 2’ du cycle glucidique des nucléosides 2’‑C‑Me/OH et 2’‑C‑Me/F. Gilead n’a breveté que deux nucléosides, confirmation que la question essentielle pour une prédiction valable est celle des substituants en position 2’ du cycle.
[281] Gilead fait en outre valoir que les essais menés par Idenix étaient trop limités pour que puisse être établie l’activité antivirale thérapeutique pour l’ensemble des revendications d’Idenix. Cette thèse concerne là encore le nombre particulièrement imposant de composés visés par la revendication 1, la plupart concernant la position 2’ (haut) ou le nombre de bases nucléosidiques dans les revendications 2 et 3. J’ai déjà examiné et écarté cette forme d’argumentation excessive en me fondant sur l’interprétation plus sélective que ferait du brevet 191 une personne versée dans l’art. Pour ce qui est du grand nombre de bases revendiquées, il a été signalé à M. Seeger en contre‑interrogatoire que les bases étaient décrites de façon semblable dans le brevet 657 de Gilead.
[282] Pour résumer, si j’exclus la question du caractère valable de la prédiction reposant sur l’analogie stérique, dont je parlerai plus loin, je conclus que le fait pour Idenix de s’appuyer sur l’activité démontrée de la cytidine 2’‑C‑Me/OH (un nucléoside) pour établir l’activité antivirale thérapeutique contre la famille des Flaviviridae, y compris le VHC, est suffisant, en tant qu’aspect parmi d’autres de son fondement factuel, pour lui permettre de prédire valablement l’activité contre le VHC d’un composé nucléosidique 2’‑C‑Me/F similaire.
3) La prédiction valable d’utilité d’après l’analogie isostérique du groupe hydroxyle par un fluor
[283] Je conclus que Gilead a démontré qu’Idenix n’avait pas de raisonnement valable pour prédire l’activité antivirale du composé 2’‑C‑Me/F d’après son hypothèse de l’« analogie stérique ». Le professeur La Colla, le seul de quatre inventeurs à témoigner, n’a pas démontré que ceux‑ci considéraient qu’une prédiction basée sur l’analogie stérique était plus qu’une possibilité. La documentation contemporaine démontre également que les inventeurs estimaient que le groupe hydroxyle en position 2’ (bas) du cycle glucidique était essentiel. La Cour conclut de même que l’opinion de M. Lamarre selon laquelle l’analogie stérique était suffisante pour permettre de prédire l’activité antivirale du composé 2’‑C‑Me/OH dans le nucléoside 2’‑C‑Me/F était au mieux une supposition éclairée non étayée par les connaissances générales courantes.
[284] La Cour accepte plutôt le témoignage de M. Seeger et d’autres selon lequel la position 2’ (bas) du cycle glucidique de D‑ribose était reconnue comme une position hautement conservée et sélective et que le fluor est trop imprévisible comme substituant en matière de toxicité potentielle pour que l’on puisse dûment conclure que la prédiction d’une activité antivirale découlant d’une substitution de l’hydroxyle par un fluor représente plus qu’une simple conjecture.
a) Le fondement factuel des inventeurs aux fins de la prédiction valable de l’utilité
[285] Le brevet 191 nomme quatre inventeurs, dont deux sont chimistes (MM. Storer et Gosselin), et deux pharmacologues (M. Sommadossi et le professeur La Colla). MM. Storer et Gosselin étaient tous deux des chimistes de recherche très expérimentés. Aucun n’a été appelé à témoigner à l’instruction, même si M. Gosselin est encore associé à Idenix et que M. Storer était un témoin clé dans les affaires d’Idenix à l’époque. Cette dernière a appelé un inventeur à témoigner, le professeur La Colla.
[286] Gilead allègue que le professeur La Colla a été bien préparé en vue de son témoignage à l’instruction et qu’il s’est fait abondamment diriger durant son interrogatoire direct. Gilead soutient qu’il n’est pas certain que le témoignage que le professeur La Colla a livré à l’instruction reflète fidèlement ce qu’il croyait et savait à l’époque pertinente. Je souscris dans une certaine mesure à cette observation, mais conclus que sa portée est un peu atténuée par le fait que le professeur La Colla témoignait dans sa langue seconde, avec l’assistance occasionnelle d’un interprète.
[287] La Cour doit néanmoins accorder moins de poids au témoignage du professeur La Colla après avoir pris la mesure de l’étonnant manque de confiance dont Idenix a fait preuve à son endroit en ne le laissant pas répondre à des questions fondamentales concernant son rôle dans l’invention au cours des interrogatoires préalables. Dans une partie de la transcription de l’interrogatoire préalable qui s’étend sur plusieurs pages, la Cour a noté que toutes les questions que Gilead a posées pour tenter de comprendre la contribution que le professeur La Colla estimait avoir faite à l’invention ont été refusées, sans exception. Idenix a finalement répondu à ces questions; certaines réponses ont été fournies au cours de l’instruction, et un autre interrogatoire préalable a été envisagé mais évité après qu’un « tas » de questions écrites eurent reçu des réponses. Lorsque la Cour apprend par des renvois à la transcription d’un interrogatoire préalable qu’une partie a surveillé de très près son propre témoin, elle ne peut que conclure qu’elle ne devrait pas prêter plus de foi au témoignage que la partie elle‑même.
[288] Mais surtout, la Cour nourrit quelques préoccupations de fond concernant le témoignage du professeur La Colla ayant trait à sa prédiction valable de l’activité antivirale des nucléosides 2’‑C‑Me/F. Dans l’ensemble, j’estime qu’il a exprimé sa prédiction valable sous la forme d’une possibilité, plutôt que d’une vraisemblance ou d’une probabilité. Il semblait d’ailleurs confondre la force de sa conviction personnelle que sa prédiction serait valable, avec la nécessité de démontrer par une preuve objective qu’il s’agissait d’une probabilité.
[289] Plus précisément, le professeur La Colla s’est appuyé à plusieurs reprises sur la demande de brevet de l’Université Emory (publication PCT no WO 99/43691, intitulée « 2’‑Fluoronucleosides » (la « demande de brevet d’Emory »), comme l’a fait Idenix, pour justifier ses conclusions que ses prédictions fondées sur l’analogie stérique étaient valables. Toutefois, la demande de brevet d’Emory était conjecturale dans ses énoncés et, plus important encore, ne contenait aucune donnée pouvant étayer une prédiction d’utilité par suite d’une substitution du groupe hydroxyle par un fluor en position 2’ (bas) du cycle glucidique.
[290] Le professeur La Colla a résumé le raisonnement qu’il a employé pour prédire l’utilité du composé 2’‑C‑Me/F dans le passage suivant :
[traduction]
LE TÉMOIN : […] Et j’étais d’avis que le composé à synthétiser en toute priorité était le 2’‑méthyl (haut) et 2’‑fluoro (bas). Si je proposais en priorité ce composé, c’est que je connaissais le brevet d’Emory –
[…]
Emory, Université Emory, le brevet d’Emory.
[…]
LE TÉMOIN : Où une énorme quantité de dérivés 2’‑fluoro étaient décrits.
J’avais deux raisons de choisir personnellement le 2’‑méthyl (haut), 2’‑fluoro (bas). D’abord, on reconnaissait dans le même brevet que le fluor pouvait être le meilleur substituant d’un groupe hydroxyle puisque la liaison CO est totalement semblable à la liaison CF, que OH et F sont des accepteurs, sont des groupes accepteurs d’hydrogène, et aussi en raison de mes connaissances plus générales acquises en travaillant avec tant de chimistes, travaux pendant lesquels nous avions souvent comme problème de tenter la synthèse de nouveaux composés en remplaçant un OH par un fluor ou vice versa. Et je me rappelais que, dans la plupart de ces cas, le choix était le bon parce que OH et fluor sont ce qu’on appelle des bioisostères, de sorte que, en remplaçant l’un par l’autre, nous ne modifions pas l’activité biologique du composé.
La troisième raison était que, dans le brevet d’Emory, l’activité antivirale des composés 2’‑fluoro était revendiquée contre les virus suivants : VIH, VHB et VHC, et, selon les revendications, tous les composés avaient une activité antitumorale.
Si je m’intéressais au spectre d’activité et à la différence entre les composés 2’‑fluoro et les composés 2’‑méthyl sur le plan de l’activité, c’est que je me posais tout simplement la question suivante : la substitution de l’OH (bas) par un fluor conférera‑t‑elle aux composés 2’‑méthyl (haut) un spectre d’activité supplémentaire ou totalement nouveau? C’était là la question.
Mais bien sûr, j’avais une réponse réservée. Il s’agissait d’une curiosité scientifique qui ne pouvait être satisfaite que par la fabrication de ce composé.
Mais la prédiction que je pouvais peut-être faire est que, d’après mes connaissances et mon raisonnement, le 2’‑méthyl (haut), 2’‑fluoro (bas) présenterait la même activité et donc le même spectre d’activité que le 2’‑méthyl (haut), 2’-OH (bas) parce que, comme je l’ai déjà mentionné, OH et fluor sont des bioisostères. Je ne pouvais donc pas croire que le bioisostère pouvait changer totalement le comportement de la molécule, un inhibiteur devenant un inhibiteur non seulement de l’ARN polymérase ARN dépendante, mais aussi des transcriptases inverses, lesquelles sont des enzymes du VIH et du VHB. Je ne pouvais croire qu’il y aurait un tel changement. J’ai préféré m’en tenir à l’hypothèse selon laquelle, à cause des bioisostères et du fait de ma ferme, ferme conviction que c’est le groupe méthyle qui dicterait le spectre d’activité général, il m’était possible de faire la predizione, la prédiction – .
[Non souligné dans l’original.]
[291] Le professeur La Colla déclare qu’il s’agissait d’une « curiosité scientifique qui ne pouvait être satisfaite que par la fabrication de ce composé ». D’après moi, le terme « que » signifie ici « seulement ». L’éventualité d’une issue positive est en outre conforme avec la nature conjecturale des termes qu’il emploie pour décrire sa prédiction, c’est‑à‑dire une conviction, une question appelant une réponse, une préférence, une hypothèse.
[292] Plus loin lors de son interrogatoire direct, afin d’expliquer sa prédiction de l’utilité malgré les doutes exprimés par d’autres chimistes de l’équipe des découvertes d’Idenix au cours de la réunion de Maui, il a déclaré ce qui suit :
[traduction]
Et j’ai pris position pour le fluor, la substitution de l’OH par un fluor, à cause du brevet d’Emory qui était extrêmement clair là‑dessus et qui avait incité d’autres inventeurs à substituer un OH par un fluor en position 2’.
[Non souligné dans l’original.]
[293] En fait, le passage de la demande de brevet d’Emory concernant la possibilité de remplacer un hydroxyle par un fluor, ce qu’Idenix présente comme la justification de sa prédiction valable, énonce une possibilité dans le meilleur des cas. Il dit ce qui suit :
[traduction]
Dans la conception de nouveaux nucléosides biologiquement actifs, il y a eu un certain nombre de tentatives d’incorporer un substituant fluor au cycle glucidique du nucléoside. Le fluor a été proposé comme substituant parce qu’il pourrait servir d’analogue isopolaire et isostérique d’un groupe hydroxyle, car la liaison C‑F est d’une longueur (1,35 Å) à peu près égale à celle de la liaison C‑O (1,43 Å) et le fluor est un accepteur de liaisons hydrogène. Le fluor peut produire d’importants changements électroniques dans une molécule en n’entraînant qu’une perturbation stérique minime. La substitution par un fluor d’un autre groupe dans une molécule peut modifier le métabolisme du substrat à cause de la grande force de la liaison C‑F (116 kcal/mol contre 100 kca/mol pour la liaison C‑H).
[Non souligné dans l’original.]
[294] Placé par la suite devant la preuve que la demande de brevet d’Emory ne contient aucune revendication d’activité antivirale ni données sur l’activité contre le VHC ou les Flaviviridae, le professeur La Colla est revenu sur sa position que le brevet était « extrêmement clair » en précisant que la demande de brevet Emory n’était utile que pour établir le [traduction] « simple fait chimique » que le groupe hydroxyle et le fluor sont des isostères.
[295] Il décrit également sa conclusion comme une [traduction] « déduction ». L’extrait suivant provient de la transcription de son contre‑interrogatoire :
[traduction]
Q. D’accord. Ainsi, le brevet d’Emory ne renferme pas de données sur l’activité contre le VHC ou les Flaviviridae, n’est‑ce pas?
R. Oui. Mais, la raison pour laquelle j’ai…
Q. Professeur
R. La raison pour laquelle je mentionne ce brevet
Q. Professeur, c’était une simple question, vous y avez répondu, il n’y a pas de données dans ce brevet, n’est‑ce pas?
R. Oui, mais ce n’est pas à cause des données que j’ai mentionné ce brevet. C’est qu’il est très clairement dit que la liaison CO est un bioisostère de la liaison CF, ce qui suffit. Je fais mention de ce brevet d’Emory seulement pour dire que d’autres personnes avaient déjà établi un simple fait chimique, que l’OH et le fluor sont des bioisostères. Je ne l’ai pas appliqué. J’ai pris pour point de départ la connaissance de ce brevet pour faire une déduction concernant tout bon composé nouveau contre le VHC. [pages 1893 et 1894]
[Non souligné dans l’original.]
[296] Je constate aussi que, au sujet de ses propres travaux comme fondement de sa prédiction, il n’a donné ni exemples ni description de ses travaux de substitution ni de composés contenant un fluor. Ce témoignage contraste avec le témoignage très précis de M. Stuyver, qui prétend avoir joué un grand rôle dans la synthèse par Gilead du composé 2’‑C‑Me/F et fait référence à cet égard à ses travaux avec des fluors, notamment son rôle dans une demande de brevet de Gilead dans laquelle le fluor était employé comme substituant en position 2’ (bas) du cycle glucidique. Malgré cela, il est d’avis qu’il ne pouvait prédire l’activité antivirale du composé 2’‑C‑Me/F, celle‑ci ne pouvant être établie que par des essais.
b) Les éléments de preuve contemporains relatifs à la prédiction d’utilité du composé 2’‑C‑Me/F
[297] Les parties ont présenté des éléments de preuve concernant un certain nombre de faits ou de documents pertinents au regard du caractère valable de la prédiction d’utilité d’un composé 2’‑C‑Me/F, s’il devait être synthétisé. L’analyse de la Cour suivra le fil de ces faits tels qu’ils ont été présentés dans les arguments d’Idenix.
(i) La discussion à la rencontre de chimie du 18 décembre 2001 à Maui où il a été question de la synthèse du composé 2’‑C‑Me/F
[298] Les éléments de preuve relatifs à la rencontre de chimie de Maui sont pertinents en ce qui concerne la prédiction du professeur La Colla et celle du groupe de chimistes d’Idenix au sujet de l’utilité des composés 2’‑C‑Me/F. À cette rencontre étaient présents les inventeurs du brevet 191 (M. Gosselin, le professeur La Colla, M. Sommadossi et M. Storer), ainsi que M. Standring et d’autres chimistes d’Idenix chargés de la découverte de médicaments. M. Storer ou M. Gosselin aurait procédé à un bilan préparatoire des questions en y allant de quelques réflexions, mais ni l’un ni l’autre n’ont été appelés à témoigner.
[299] Idenix renvoie à des passages des notes de la rencontre qui confirment que [traduction] « [l]e substituant 2’Me est nettement important et semble apporter une contribution essentielle à l’activité ». M. Lamarre dit qu’on ne saurait assez insister sur l’importance de cette conclusion. M. Seeger conteste ce point en déclarant que l’activité antivirale ne découle pas nécessairement de l’addition de molécules A et B. De son côté, Idenix ne conteste pas réellement qu’un changement de substituant dans un composé quelconque puisse modifier radicalement les caractéristiques de ce composé. L’élément de preuve le plus pertinent à cet égard est la façon dont la similitude du fluor et du groupe hydroxyle peut constituer le fondement d’une prédiction valable d’activité antivirale probable à la suite d’une substitution par un fluor.
[300] Sur ce point, les notes de la rencontre renferment des prédictions de l’efficacité probable d’autres analogues 2’‑C‑Me/OH qu’Idenix envisageait de synthétiser en remplaçant le 2’‑hydroxyl par un éventail d’autres substituants. Les notes font nettement état d’une prédiction négative d’utilité de tout nucléoside dont la synthèse est proposée avec divers substituants pour remplacer le groupe 2‑hydroxyl du cycle glucidique.
[traduction]
Le 2’-hydroxyl
Pour un virus à ARN, nous prévoyons que cela serait essentiel, mais il serait bon de vérifier avec quelques composés clés dans les séries 2’bêta‑Me C et G ce que seraient précisément les exigences, car les composés d’intérêt ont un OH tertiaire plutôt que l’habituel OH secondaire. Les analogues sans OH confirmeront probablement ce caractère essentiel, mais la chose est à faire. Pourrait‑on remplacer l’OH par d’autres groupes permettant l’acceptation ou le don de liaisons H? Les groupes intéressants pourraient être très nombreux, notamment NH3, NHAc, CN, F (bien qu’il soit souvent toxique), CO2H, CONH2, OMe. La priorité devrait être de vérifier si l’OH peut être déplacé en fabriquant un CH2OH. Si c’était possible, on pourrait songer à une grande variété d’autres cycles glucidiques à 5 membres comme ceux à hétéroatomes supplémentaires. Il serait aussi bon de voir si la position de l’hydroxyle serait accessible au CH2OH par la position 1’ ou 3’.
[Non souligné dans l’original.]
[301] Les notes présentent une prédiction pessimiste concernant tout composé où le groupe hydroxyle serait remplacé par un fluor, puisqu’on prévoyait 1) que l’hydroxyle [traduction] « serait essentiel » et 2) que les analogues fabriqués [traduction] « confirmeront probablement ce caractère essentiel ». On y décrit aussi 3) un certain nombre de substituants à envisager en remplacement du 2’ hydroxyl, et le fluor n’était pas le principal composé considéré. Le fluor était toutefois distingué des autres 4), étant décrit comme [traduction] « souvent toxique ».
[302] Les opinions exprimées dans ces notes semblent concorder avec l’opinion de Gilead selon laquelle on ne pouvait s’attendre en juin 2003 à une utilité probable du composé 2’‑C‑Me/F s’il devait être synthétisé.
[303] Le professeur La Colla a témoigné du caractère « essentiel » de la position 2 de l’hydroxyle de la manière suivante :
[traduction]
Q. « Pour un virus à ARN, nous prévoyons que cela serait essentiel » [précité]
À quoi cela fait‑il référence?
R. De même que le méthyle (haut) était reconnu comme fondamental pour l’activité anti-ARN additionnelle, de même la position 2’‑hydroxyl (bas) était jugée importante par définition, parce que cette position rend le nucléoside, le nucléoside physiologique ou les analogues ribo utilisables pour la synthèse de l’ARN, le nucléoside, les nucléosides physiologiques et les analogues nucléosidiques inhibiteurs, plus particulièrement ceux ayant un 2’ méthyl (haut).
Donc, en bref, l’idée était qu’il existait une possibilité de substituer l’OH par un autre groupe permettant les liaisons hydrogène. Et la réponse a fait l’objet de longues discussions, chacun s’amenant avec sa propre proposition ou sa façon de considérer ce problème d’après la documentation spécialisée que nous connaissions tous.
Donc si vous le permettez, je peux vous dire quelle était ma position.
Ma position était que le composé à synthétiser en priorité était le 2’‑méthyl (haut), 2’‑fluoro (bas).
Les raisons pour lesquelles j’ai dû proposer cette priorité reposaient sur les connaissances issues du brevet Emory.
[Non souligné dans l’original.]
[304] Le témoignage du professeur La Colla confirme que les autres chimistes d’Idenix pensaient que le groupe hydroxyle se révélerait sans doute essentiel en raison de son rôle sélectif dans l’ARN. Le professeur cite une fois de plus la demande de brevet d’Emory comme fondement de sa prédiction valable. De plus, dans ses domaines de spécialité, il semble se ranger à l’avis de M. Seeger que la position 2’ (bas) du cycle de l’ADN/ARN est unique à cause du rôle profond qu’elle joue dans la biologie physiologique.
[traduction]
Et il existe deux types de nucléosides, l’un avec l’OH à cette position [2’ bas], les nucléosides physiologiques, et un autre genre de nucléosides physiologiques portant un H à cette position. Parce que l’oxygène est absent, ces derniers composés sont appelés désoxy. Les ribo servent à construire l’ARN et les désoxyribo, l’ADN. Donc, entre les deux composés, il existe une grande différence sur le plan de l’utilité. La Colla, page 1460.
[Non souligné dans l’original.]
(ii) La toxicité – 7 mars 2002 – Gemcitabine, publication du brevet de Roche WO 02/18404 (le brevet 404)
[305] Quant à l’observation selon laquelle le fluor est souvent toxique, le professeur La Colla ne pouvait naturellement pas se souvenir des discussions spécifiques qui s’étaient tenues à la réunion de Maui. Il a néanmoins déclaré pendant son témoignage qu’il ne souscrivait pas à cette observation compte tenu des conclusions qu’il a tirées de la demande Emery décrite plus haut.
[306] Pour ce qui est de la toxicité, le brevet 404 de Roche, mentionné dans le brevet 191, a été commenté par M. Lamarre dans le rapport qu’il a soumis en réponse. Le brevet 404 contient une revendication visant un analogue nucléosidique di‑fluoro ayant une structure 2’‑F (haut), 2’‑F (bas).
[307] Ces composés sont similaires au médicament gemcitabine, à ne pas confondre avec le procédé de la gemcitabine comme moyen de synthèse du composé 2’‑C‑Me/F dont il est question dans la section ci‑après sur la divulgation de la synthèse. La gemcitabine est utilisée depuis longtemps dans le traitement du cancer; c’est donc un médicament qui tue les cellules. M. Seeger a brièvement expliqué le contexte de la manière suivante :
[traduction]
[…] d’abord évaluée à titre d’agent antiviral potentiel – j’en ai déjà parlé [dans mon rapport]
– a été jugée trop toxique à l’époque pour constituer un agent antiviral utile et a plutôt été mise au point en tant qu’agent anticancéreux. Elle est utilisée aujourd’hui contre le cancer du pancréas et d’autres cancers. (page 856)
[308] En se fondant sur le brevet 404, Idenix fait valoir que [traduction] « la personne versée dans l’art et les inventeurs savaient que les substitutions par un fluor en position 2’ n’étaient pas toxiques ».
[309] J’estime que cette affirmation revient à faire dire à M. Lamarre plus qu’il n’entendait. Son affirmation n’avait pour but que d’atténuer l’assertion que les fluorures peuvent être toxiques, ce dont il convient ouvertement aux paragraphes suivants :
[traduction]
[229] Les inventeurs ont envisagé des substitutions par un fluor, même s’il était admis que certains composés contenant un fluor, mais pas tous, pouvaient être toxiques pour l’hôte.
[230] En effet, les inventeurs connaissaient les publications internationales de Roche (WO 02/18404) et d’Emory (WO 99/43691) et les ont incluses à la page 10 du brevet 191. Ces deux publications divulguent que le 2’-F (bas) peut être utilisé pour conférer une activité antivirale pour le traitement de l’hépatite C.
[Non souligné dans l’original.]
[310] Comme je l’ai souligné, la demande de brevet d’Emory ne fait qu’évoquer la possibilité que le fluor confère une activité contre le VHC. En ce qui concerne le brevet 404 visant la gemcitabine, M. Lamarre n’en fait pas le fondement d’une prédiction valable, mais s’en sert plutôt pour réfuter les craintes au sujet d’une toxicité toujours présente.
[311] De plus, M. Seeger fait mention de la gemcitabine et des vaines tentatives de placer un fluor en position 2’ (bas) du cycle glucidique, avec un hydroxyle en position (haut). Je cite son témoignage à la page 863 de son interrogatoire principal, où il fait observer que le cycle glucidique doté d’un fluor (bas) et d’un hydroxyle (haut) en position 2’ tue les cellules :
[traduction]
Q. Au point c) du paragraphe 224, vous parlez d’analogues nucléosidiques et de cytotoxicité. Pouvez‑vous faire connaître à la Cour ce qu’en est la compréhension du virologue versé dans son art?
R. J’ai fait allusion hier à l’aspect historique de la découverte de médicaments en relation avec les analogues nucléosidiques. J’ai voulu signaler que, d’un point de vue historique, ce domaine a vu le jour dans celui du traitement du cancer. Le but était de tuer les cellules cancéreuses parce qu’elles se divisaient rapidement. Ce n’est qu’après que les virologues sont entrés en scène. Le défi là encore était de trouver des produits non toxiques. Je parle ici d’un médicament contre le cancer. Il s’appelle la gemcitabine. Ce qui est intéressant au sujet de ce médicament, c’est qu’il possède un fluor (bas), en position (bas). Il possède aussi un fluor en position (haut). Ce qui est particulièrement intéressant, c’est que, dans les années 1980, des chimistes d’Eli Lilly ont dit : « Si j’ai un fluor (haut) et un hydroxyle (bas), je vais mettre le fluor en position (bas). Je pourrais avoir un grand antiviral, un nouvel antiviral. » Il l’a produit, et le virologue lui a ensuite dit : « En fait, votre médicament tue les cellules. »
[Non souligné dans l’original.]
[312] Il n’est pas clairement établi que le brevet 404 de Roche, bien qu’il en soit fait mention dans le brevet 191, était connu du professeur La Colla. Ses commentaires n’ont pas été sollicités à son sujet dans une revue pourtant détaillée des données étayant sa prédiction d’utilité du composé 2’‑C‑Me/F. Néanmoins, concédant qu’il est difficile de réfuter la connaissance de ce brevet par les inventeurs alors qu’il en est fait expressément mention dans le brevet, je conclus que les inventeurs connaissaient le contenu du brevet 404. À cela s’ajoute le témoignage de M. Seeger sur l’historique toxicologique des modifications à la position 2’ que je viens de décrire.
(iii) La réunion de stratégie et d’étape d’Idenix le 2 octobre 2002
[313] Environ 10 mois après la rencontre de Maui, une réunion de stratégie et d’étape a été organisée par Idenix. Dans l’intervalle, les travaux sur les analogues nucléosidiques 2’‑C‑Me/OH se sont poursuivis sans que des progrès ne soient réalisés concernant la synthèse du composé 2’‑C‑Me/F. Les diapositives prouvent non seulement que le composé 2’‑C fluorure (bas) n’était pas la « tête de série » ou la cible principale à l’époque, mais également que les expériences portaient sur les positions 2’ et 3’ du cycle glucidique.
[314] L’absence générale de progrès dans la synthèse de nouveaux analogues 2’‑C‑Me/OH est évidente d’après les diapositives utilisées à la réunion. La diapositive ci‑après montre qu’il ne s’était guère accompli de progrès dans l’intervalle :
[315] La suite de la diapositive à la page 10 démontre que, à l’époque, le composé 2’‑C‑Me/F n’était toujours pas le seul composé cible en cours de développement.
[316] Le professeur La Colla a fait les observations suivantes à l’égard de la figure du milieu (dans ces figures, le méthyle est placé par déduction en position 2’ (haut) du cycle ribose) :
[traduction]
Ce composé était mon composé préféré à l’époque, il contient un 2’‑méthyl (haut) et un 2’‑fluor (bas). Que les chimistes aient accepté de le mettre a permis aux composés d’être synthétisés et qu’ils disent qu’il y a actuellement des progrès m’a tout à fait réjoui, mais c’est dire aussi qu’ils ont accepté toute la prédiction et son fondement.
[317] La déclaration du professeur La Colla selon laquelle il préférait un composé aux autres renvoie à une idée de tri. À mon avis, cela ne signifie pas que le composé en question, s’il était fabriqué et mis à l’essai, présenterait probablement une certaine utilité.
[318] Par ailleurs, je n’accepte pas la conclusion du professeur La Colla selon laquelle la décision d’Idenix de tenter de synthétiser le composé révélait qu’elle acceptait sa prédiction, ou que son éventuelle synthèse permettait de conclure à l’existence d’une utilité probable.
[319] La preuve en l’espèce laisse croire fortement que l’industrie pharmaceutique procède d’une manière qui consiste, si je puis dire, à [traduction] « fabriquer et [à] mettre à l’essai » tous les composés candidats dont les chances de succès sont raisonnables. En d’autres mots, les fabricants de médicaments n’ont pas besoin d’une probabilité ou d’une vraisemblance de succès pour décider d’aller de l’avant et de synthétiser un nouveau composé pour le mettre à l’essai.
[320] L’approche décrite dans le procès‑verbal de la réunion de Maui de décembre 2001 ressemble certainement au procédé consistant à fabriquer et à mettre à l’essai une série d’analogues candidats. Une liste de substituants possibles en position 2’ HO a été établie en vue de la mise au point, bien que le procès-verbal de la réunion n’ait guère évoqué de chances de succès.
[321] Cette méthodologie a été confirmée de manière indépendante par la déposition de M. Patterson. Il a décrit ainsi son hésitation à mettre à l’essai des analogues en se servant de la demande de brevet d’Idenix :
[traduction]
M. Schinazi s’est amené avec la nouvelle que le composé que nous appelions le composé d’Idenix était actif contre l’hépatite C. Il voulait que nous fabriquions des analogues. M. Watanabe a présenté un certain nombre d’analogues d’intérêt. Personne n’était particulièrement désireux de fabriquer cette molécule [HO substitué par un fluor], et je ne l’étais certainement pas parce que nous savions qu’elle avait été fabriquée par Idenix et nous étions certains qu’Idenix aurait couvert tous les analogues raisonnables.
[Non souligné dans l’original.]
[322] La description que donne M. Patterson de la certitude du comportement prévisible d’Idenix consistant à fabriquer et à mettre à l’essai tous les analogues raisonnables s’applique à ce qui s’est produit lors de la rencontre de décembre 2001 à Maui. Le fluorure constituait un analogue raisonnable d’après une possibilité d’activité, tout comme un certain nombre d’autres substituants.
[323] Par ailleurs, si la tentative de synthèse d’un nouveau médicament constituait la preuve d’une prédiction valable, ce critère deviendrait circulaire et tautologique. La décision de tenter la synthèse prédirait l’utilité, par opposition à la prédiction d’une utilité ou non du composé s’il était synthétisé.
(iv) Le 28 novembre 2002 - demande de brevet no WO 02/094289 (le brevet 289) de Roche
[324] La demande suivante de brevet de Roche, le brevet 289, décrit l’activité antivirale d’un composé décrit comme une 2’‑désoxy‑2‑fluorocytidine ayant un seul fluor en position 2’ (bas) du cycle glucidique. La première et seule mention de la demande de brevet 289 de Roche a eu lieu pendant l’interrogatoire principal de M. Stuyver. Celui‑ci a signalé que la publication de Roche était antérieure à sa demande non publiée de brevet de Pharmasset (la demande de brevet américain 60357411). Elle décrivait un composé similaire de Pharmasset (PSI‑0262) qui établissait l’activité antivirale du même composé au moyen d’essais sur réplicon du VHC.
[325] Bien qu’elle ait été publiée en 2002, la demande de brevet 289 n’était pas citée dans le brevet 191. Aucun des experts ou des autres témoins n’en ont fait mention dans leurs rapports ou témoignages. Elle n’a pas été portée à l’attention du professeur La Colla, ni été évoquée au cours de son témoignage. Je ne suis pas convaincu que le brevet 289 était connu des inventeurs du brevet 191 à la date de dépôt. Par conséquent, il n’est pas considéré comme faisant partie de leurs connaissances aux fins de la détermination de l’utilité du brevet 191.
(v) Du 1er au 4 avril 2003 – Résumé d’un cours interne de mise à jour scientifique sur la fluoration mis sur pied par Idenix
[326] Idenix prétend qu’il était clair que la prédiction relative à l’utilisation du fluor au lieu du groupe hydroxyle était bien connue en son sein, à en juger par l’information transmise à l’occasion d’un cours de mise à jour scientifique sur la fluoration. M. Griffon et Audrey Chappe y ont assisté en vue de faciliter la synthèse du nucléoside 2’‑C‑Me/F. Ils ont rédigé un rapport dont il a été dit par la suite qu’il avait été transmis en tant que pièce jointe dans un courriel daté du 9 juin 2003, plus de deux mois plus tard, envoyé par M. Storer à Moussa Chadhari. D’après M. Lamarre, ce rapport montre que la prédiction relative à l’utilisation du fluor au lieu du groupe hydroxyle était bien connue chez Idenix. À la page 3 du résumé, il est dit en effet que le remplacement du groupe hydroxyle par un fluor se traduirait par un effet semblable avec le donneur de liaisons hydrogène.
[327] Le rapport n’a pas été mentionné par le professeur La Colla, en ce qui concerne les renseignements reçus deux semaines avant le dépôt de la demande de brevet, alors que M. Storer n’a pas témoigné. Il semble être question de l’avis exprimé par un des formateurs du programme au sujet de la synthèse, et non des propriétés pharmaceutiques d’un nucléoside 2’‑C‑Me/F. À cet égard, il ne s’agit apparemment de rien de plus que de la déclaration figurant dans la demande de brevet Emory, juste plus généralisée sur les propriétés physiques, et encore moins sûre et moins fiable sur le plan des sources. Elle n’aborde manifestement pas les autres questions comme les problèmes de toxicité associés au fluor. Je ne peux attribuer beaucoup de poids à cet élément de preuve compte tenu de sa source et de la manière dont il a été présenté à la Cour.
c) La déposition des experts
(i) L’avis de M. Lamarre sur l’analogie stérique
[328] M. Lamarre était l’expert d’Idenix dont on a dit qu’il était le seul qualifié pour se prononcer tant sur la virologie que sur les propriétés isostériques des atomes et des composés. Son avis d’expert en cette matière n’a pas été contesté lors du contre‑interrogatoire.
[329] La déclaration générale de M. Lamarre concernant le résultat prédit de la substitution du groupe hydroxyle par un fluor figure au paragraphe 172 de son rapport :
[traduction]
Le 27 juin 2003, la personne versée dans l’art aurait également su que, lorsqu’on conçoit de nouveaux nucléosides biologiquement actifs à l’aide d’une conception rationnelle basée sur le substrat, les groupes hydroxyle (OH) du nucléoside peuvent souvent être remplacés par des atomes de fluor (F).
[Non souligné dans l’original.]
[330] En tout respect, je ferai remarquer que cette déclaration n’est pas aussi forte qu’elle devait l’être pour qu’il soit possible de prédire une probabilité d’activité antivirale des nucléosides 2’‑C‑Me/F. Le terme « souvent » ne représente pas une mesure concrète inférieure ou supérieure à une probabilité de résultat. Ce serait plutôt un terme de compromis parfois utilisé lorsqu’on est peu désireux d’énoncer une proposition claire, mais c’est aussi loin que l’expert souhaite aller. De toute façon, l’opinion est au mieux ambiguë comme preuve indirecte de prévisibilité, et ce n’est pas ce qu’on attendrait d’un expert appuyant une prédiction valable d’analogie stérique.
[331] La déclaration ne s’applique pas non plus uniquement à la question de l’utilité : elle s’applique généralement aux situations où l’on « conçoit de nouveaux nucléosides biologiquement actifs ». Le point ici ne concerne pas la conception de nouveaux nucléosides. Idenix n’a pas suivi de processus de conception rationnelle. La preuve démontre qu’Idenix a procédé exactement comme M. Patterson a dit qu’elle le ferait, c’est‑à‑dire en tentant de synthétiser tout nombre possible d’analogues 2’‑C‑Me/OH en vue d’en vérifier l’activité antivirale, sans aucune probabilité de succès au départ.
[332] L’essentiel de l’opinion de M. Lamarre au sujet de l’analogie stérique figure au paragraphe 173 de son rapport, où il cite une partie de l’introduction d’un article de 1998 du professeur Jeffrey McAtee et al. intitulé « A Completely Diastereoselective Electrophilic Fluorination of a Chiral, Noncarbohydrate Sugar Ring Precursor : Application to the Synthesis of Several Novel 2′‑Fluoronucleosides », publié dans The Journal of Organic Chemistry, volume 63, pages 2161 à 2167.
[333] Comme la demande de brevet d’Emory s’appuyait sur l’article de McAtee pour ce qui est des propositions qu’elle cite en matière d’analogie stérique, cet article semble se situer au cœur de ce que fait valoir Idenix. Outre l’article de McAtee, aucune autre publication n’est citée au sujet de la substitution du groupe hydroxyle par le fluor en position 2 du cycle glucidique.
[334] M. Lamarre a cité l’extrait suivant de l’article à l’appui de ses conclusions; c’est lui qui souligne et met les notes de bas de page entre crochets :
[traduction]
Le fluor pourrait aussi servir d’analogue isopolaire et isostérique d’un groupe hydroxyle, car la liaison C‑F est d’une longueur (1,35 Å) à peu près égale à celle de la liaison C‑O (1,43 Å) et le fluor est un accepteur de liaisons hydrogène. La capacité du fluor à imiter le groupe hydroxyle désigne tout particulièrement cet atome pour la fabrication d’analogues nucléosidiques en tant que substituant de l’OH dans la partie glucidique d’un nucléoside. Outre notre intérêt de longue date pour la synthèse de nouveaux analogues nucléosidiques, [3] nous étions désireux d’incorporer un substituant R‑fluor en position 2 du cycle glucidique pour plusieurs raisons. D’abord, l’électronégativité du fluor devrait stabiliser la liaison anomérique et supprimer une importante voie de décomposition in vivo, [4] améliorant de ce fait la stabilité acide du nucléoside (schéma 1).
Ensuite, les groupes hydroxyle servent souvent de « poignées » pour la première étape de la dégradation oxydative des biomolécules in vivo. [2c] En remplaçant l’OH par un F, il est possible de créer un sucre analogue au ribo qui porte en position 2 un substituant similaire à un groupe hydroxyle sur les plans stérique et électronique, mais qui ne peut subir de catabolisme oxydatif.
[Souligné par M. Lamarre]
[335] Gilead n’a pas contre‑interrogé M. Lamarre sur cet élément de preuve, mais la Cour a droit à quelques observations sur certains des aspects évidents de l’article de McAtee. Tout d’abord, la proposition de substituer un hydroxyle par un fluor dans cet article est exprimée sous forme de possibilité : [traduction] « Le fluor pourrait aussi servir d’analogue isopolaire et isostérique d’un groupe hydroxyle » et [traduction] « [e]n remplaçant un OH par un F, il est possible de créer un sucre analogue à un ribo ».
[336] Ensuite, l’extrait de l’introduction de l’article cité par M. Lamarre n’a rien à voir avec l’objet de l’étude. Celle‑ci faisait état de tentatives infructueuses de synthèse de nucléosides 2’‑fluoro (bas), parce que peu de ces produits existaient, comme le décrit le passage qui suit immédiatement celui cité par M. Lamarre :
[traduction]
Enfin, peu des dérivés de nucléosides ribo ou 2’‑fluoro (bas) étaient connus. Nous avons donc tenté de trouver un moyen simple et efficace de synthétiser ces composés pour produire de nouveaux analogues qui pourraient faire l’objet d’une évaluation biologique.
[337] Les auteurs n’ont pas réussi à synthétiser des nucléosides fluorés qui seraient soumis à une évaluation biologique, car seulement deux des dix composés synthétisés se sont révélés actifs, et ils se sont aussi avérés toxiques. ([traduction] « Malheureusement, seuls les composés 15b et 18b avaient une activité contre le VIH, et ils étaient aussi toxiques, ce qui indique qu’ils étaient des inhibiteurs non sélectifs du VIH » (à la page 2163)). Cette expérience ratée semble aller tout à fait à l’encontre d’une prédiction valable d’activité antivirale en plus de nier les connaissances générales courantes en faveur de la prévisibilité de l’activité ou de la non‑toxicité des nucléosides 2’-fluoro (bas).
[338] Plus important encore, aucune note de bas de page ne vient étayer les extraits d’article cités par M. Lamarre dans son rapport, quoique d’autres déclarations issues du commentaire s’accompagnent de telles notes. Compte tenu de cette absence apparente d’articles justificatifs, je me serais attendu à ce que les publications et les documents parus entre 1998 et 2003 contiennent des exemples de fluors « analogues » au 2’‑hydroxyl (bas). Je ne vois donc aucune raison de juger qu’une preuve suffisante a été fournie pour confirmer que les propositions selon lesquelles le fluor pouvait remplacer un hydroxyle en raison de leur analogie stérique représentaient les connaissances générales courantes ou étaient dûment étayées par les publications.
[339] En outre, la Cour n’a pas besoin d’avis d’experts pour se rendre compte que, si l’article de McAtee est le meilleur que M. Lamarre pouvait offrir comme fondement de sa prédiction valable, cela en dit très long quant à la nature hypothétique de sa proposition. Cela expliquerait aussi pourquoi, en tant que scientifique, il semble réticent à proclamer plus résolument la probabilité de la prédiction de l’utilité des nucléosides 2’‑C‑Me/F.
[340] Enfin, quelques observations s’imposent au sujet du témoignage de M. Lamarre où celui‑ci a introduit un facteur appelé [traduction] « relation structure‑activité », ou RSA, qui semble pertinent au regard de l’argument de l’analogie, mais qui n’est pas mentionné dans son rapport. Je cite un passage assez long de la transcription du témoignage de M. Lamarre où il présente ce concept lorsqu’il a été question d’analogie stérique :
[traduction]
Q. Donc, au paragraphe 171, vous dites « compte tenu de ce fondement »; quelle est votre opinion de ce que la personne versée dans l’art en saisirait, en commençant par le fondement qui était connu des inventeurs?
R. Ainsi, les inventeurs étaient, je suppose, tout à fait au courant de l’importance de la position 2’, le méthyle « haut » tenant une grande place dans l’invention, et l’OH (bas), qui est dans le substrat naturel, ils savaient que cette, que l’enzyme est tout à fait, vous savez, que l’enzyme peut faire une différence à cette position si un hydrogène est à cette position au lieu d’un OH. L’hydrogène qui est dans un nucléotide à désoxyribose et qui est utilisé dans l’ADN, par exemple.
Il est donc clair que l’OH est un groupe important à cette position.
LE JUGE ANNIS : Je vous suis mal, j’aimerais mieux comprendre. Je n’ai entendu personne encore parler du H et de l’OH – le H est l’ADN, vrai, et l’OH est pour le –
LE TÉMOIN : C’est exact. Nous avons dit que l’OH est dans les ribonucléotides à cette position. Et dans les désoxy –
LE JUGE ANNIS : C’est un H.
LE TÉMOIN : C’est un H, oui. Et ces substrats servent à la synthèse de l’ADN, et maintenant nous parlons d’un virus dont le génome est constitué d’ARN. Donc, même s’il y a dans la cellule beaucoup d’attraction exercée par le désoxynucléotide
LE JUGE ANNIS : Mais le méthyle H aurait‑il, a‑t‑il fonctionné, avait‑il une activité antivirale?
LE TÉMOIN : Le H?
LE JUGE ANNIS : Le méthyle H, oui.
LE TÉMOIN : Non.
LE JUGE ANNIS : Il ne fonctionne pas du tout?
LE TÉMOIN : Non, c’est justement ce que je voulais dire, l’enzyme est réellement capable de différencier l’OH des hydrogènes justement parce qu’il a un génome à ARN et qu’il n’utilisera pas le H (bas). Vous savez, il y a beaucoup d’attraction dans les cellules et il peut donc distinguer les deux.
Donc, la position 2 est très, vous savez, ce qu’on appelle RSA est limité à cette position.
LE JUGE ANNIS : Qu’est‑ce que le RSA?
LE TÉMOIN : C’est la relation structure‑activité. Quand les chimistes explorent –
LE JUGE ANNIS : Structure?
LE TÉMOIN : La relation structure‑activité. C’est un terme que nous utilisons en chimie médicinale.
Donc, à cette position, le fluor, c’est le point important dans ce brevet, le fluor est considéré comme un très bon analogue isostérique de par sa nature, du fait de la taille de cet atome qui est proche de, qui a une taille similaire à l’OH, et aussi parce que cet atome de fluor, lorsqu’il est lié aux carbones à cette position 2’, la longueur de la liaison C‑F est similaire à celle de la liaison COH ou CO, hydrogènes.
Vous avez donc un atome d’une taille similaire au bon endroit, à cet endroit, qui est un bon analogue pour ce type d’inhibiteur.
[Non souligné dans l’original.]
[341] Le concept analytique de relation structure‑activité semble pertinent en l’espèce, ou du moins au regard de l’argumentation d’Idenix fondée sur l’analogie structurale pour rendre actif l’analogue nucléosidique.
[342] C’est en m’appuyant sur ce passage que j’en suis venu à la conclusion déjà exprimée que M. Lamarre souscrivait à la proposition générale de M. Seeger selon laquelle la position 2’ (bas) du nucléoside de l’ARN est hautement sélective. Je crois que cette affirmation est aussi étayée par les énoncés suivants de M. Lamarre : [traduction] « beaucoup d’attraction » et [traduction] « ce qu’on appelle RSA est limité à cette position ».
[343] En d’autres termes, il semble ressortir de son témoignage que la position 2’ (bas) du cycle ribose est hautement sélective à l’égard de la structure, ce qui explique que le fluor aurait les meilleures chances de remplacer l’hydroxyle tout en gardant son activité, et ce, malgré un RSA limité et l’attraction à cette position.
[344] J’estime que M. Lamarre était un témoin très honnête. Je suis convaincu qu’il a fait de son mieux pour donner son avis tout en veillant à ne pas déborder. Il savait qu’il ne pouvait pas aller plus loin et s’en est tenu là. Cela dit, je ne crois cependant pas dans les circonstances, à en juger par son propre témoignage très nuancé, qu’il ait démontré que l’activité antivirale soit probable lorsqu’on substitue le 2’‑hydroxyl (bas) par un fluor sur le cycle du ribose.
[345] Pour convaincre la Cour, il aurait fallu lui fournir davantage d’éléments de preuve tirés des publications et peut‑être davantage d’éléments de preuve au sujet du concept de relation structure‑activité. S’il est généralement admis que la position 2’ (bas) du cycle du ribose présente une « RSA limitée », on peut penser qu’il existe des mesures comparatives de l’« attraction » pouvant servir à mesurer l’activité. De toute manière, ce ne sont là que des spéculations, mais le manque d’éléments de preuve pour étayer les allégations d’Idenix n’a quant à lui rien d’une spéculation.
[346] En outre, l’article de McAtee paraît étayer la conclusion selon laquelle il faut toujours se préoccuper de la toxicité même si l’analogue nucléosidique se révèle actif, tout comme il a été mentionné à la rencontre d’Idenix à Maui. Qu’Idenix ait eu à s’en remettre à ce qui apparaît franchement comme un article inutile publié en 2009 pour présenter une argumentation fondée sur une analogie stérique prévisible en 2003 montre l’absence d’une documentation solide et donc de données expérimentales étayant l’assertion d’une utilité probable découlant de la substitution de l’hydroxyle par un fluor dans le nucléoside 2’‑C‑Me/OH.
[347] Il n’est pas inattendu qu’un composé encore à inventer et dont Idenix prévoit qu’il pourrait occuper une position chimique hautement sélective et essentielle en science médicale ait une activité thérapeutique contre un virus des plus pernicieux.
(ii) L’opinion de M. Seeger concernant la nature conservée du groupe 2’‑hydroxyl (bas) sur le cycle glucidique
[348] Même si j’estime que la déposition de M. Lamarre ne satisfait pas aux exigences voulues pour établir une prédiction valable (ce fardeau juridique n’incombant pas à Idenix), les avis de M. Seeger, déjà annoncés par les extraits cités du témoignage de M. Lamarre, déchargent Gilead de son fardeau en évoquant la capacité sélective du groupe 2’‑hydroxyl (bas) à distinguer les analogues de l’ARN des analogues de l’ADN.
[349] Le témoignage de M. Seeger revient foncièrement à prédire que tout changement au niveau du groupe hydroxyle constituera [traduction] « un gros changement à un endroit important de l’ARN ». Sa déposition est probablement le mieux illustrée par le contre‑interrogatoire visant à contester certaines de ses opinions, qui ne me semblent pas avoir rempli cet objectif, et non par faute d’efforts.
[350] M. Seeger fait observer que toute modification d’un composé en modifiera les propriétés. Le fait de commencer avec un méthyle (haut) et l’hydroxyle (bas) qui confère au nucléoside 2’‑C‑Me/OH son activité antivirale n’y change rien.
[traduction]
Q. Ils ont acquis davantage de connaissances concernant cette position dans un composé doté d’un 2’‑méthyl (haut)?
R. Non. L’hydroxyle est là. Ils laissent l’hydroxyle à sa position naturelle. En fait, ce à quoi on s’attend, nous en avons parlé ce matin, est qu’un changement sera probablement considérable ou qu’il sera profond. Nous pouvons néanmoins essayer. Pourquoi pas? Essayons d’élucider la chose. En réalité, le méthyle est un méthyle (haut). C’est le méthyle (haut), et nous parlons ici de l’hydroxyle (bas). L’hydroxyle est toujours là, il a toujours la structure de l’ARN, si vous voulez, avec ce méthyle (haut).
Q. C’est le point de départ pour eux. Ce n’est pas n’importe quel composé. Vous commencez avec un méthyle (haut) et un OH (bas). Vous avez un corpus de données à ce sujet?
R. Dans ce cas, ce n’est pas une question d’addition. En d’autres termes, vous ne vous dites pas : « Maintenant j’ai A ici, puis je pars de A plus B égale cela. » Toute molécule que vous fabriquez a dès lors ses propres propriétés nouvelles. Si vous changez un atome, toute la molécule s’en trouve influencée, n’est‑ce pas? Voilà pourquoi c’est nouveau pour tout le monde que vous commenciez par un méthyle ou la base naturelle ou quoi que vous fassiez. Vous créez quelque chose de nouveau.
[Non souligné dans l’original.]
[351] M. Damha a dit à peu près la même chose, en évoquant notamment la variabilité que peut introduire le fluor dans les composés (pages 2026 et 2067) :
[traduction]
LE TÉMOIN : Ainsi, lorsque vous remplacez un groupe OH par un fluor, l’OH est un groupe fonctionnel polaire. Le fluor est moins polaire, mais il est électronégatif comme les oxygènes. C’est pourquoi, lorsque vous remplacez un OH par un fluor, vous conservez le même type d’électronégativité du groupe, mais vous la modifiez légèrement de manière à doter les molécules de propriétés différentes.
Ainsi, j’évoque le fait qu’un grand nombre de composés organiques fluorés possèdent des propriétés intéressantes, comme on l’a constaté pour bien des types de molécules, de stéroïdes et de nucléosides.
[352] Dans la décision Alcon Canada Inc c Cobalt Pharmaceuticals Company, 2014 CF 462 (Alcon/moxifloxacine), au paragraphe 160, le juge Michael Phelan notait que même de petits changements peuvent avoir des effets considérables sur l’activité.
[160] Un certain nombre d’experts ont examiné l’importance de la stéréochimie des composés de la revendication 12. Il semble qu’ils s’entendent tous à dire que même de petites modifications à une molécule peuvent avoir des effets considérables sur l’activité.
[Non souligné dans l’original.]
[353] De l’avis de M. Seeger, le changement au niveau du groupe hydroxyle est un « gros changement à un endroit important » (non souligné dans l’original), mais on ignore tout simplement quelles en seront les répercussions :
[traduction]
R. La famille des polymérases, elles ont cette distinction. Il y a des indications structurales quant à la raison pour laquelle c’est le cas, et je pourrais m’étendre là-dessus. Je ne le ferai pas, parce que ça prendrait du temps. C’est exactement le point, cette distinction. Voilà pourquoi, quand vous modifiez ce résidu, vous ignorez s’il fonctionnera, s’il ira dans l’ARN ou dans l’ADN. Il doit y avoir un impact.
[…]
Q. C’est votre conclusion quand vous lisez cette citation?
R. Non. Ce n’est pas la conclusion que moi j’en tire. Là encore, je ne manipule pas les constituants de la nature, n’est‑ce pas? Il n’y en a que deux types. Le seul élément distinctif est cet hydroxyle. Si vous lui apportez un changement chimique, ce changement doit avoir un impact.
[…]
Q. Pouvons‑nous maintenant regarder le paragraphe suivant de votre affidavit où vous dites qu’il peut y avoir des répercussions importantes. Vous dites que les « modifications en position 2’ peuvent avoir des répercussions importantes », pas qu’elles doivent?
R. Je peux dire « peut ». Je peux dire « doit ». Je dis tout simplement que c’est la région la plus conservée. C’est là une distinction importante. Vous apportez un changement, vous vous attendez à des répercussions. Il peut ou il doit y avoir des répercussions. Choisissez le mot que vous voulez. C’est un gros changement à un site très important.
[Non souligné dans l’original.]
[354] M. Seeger s’est dit d’avis en résumé que les résultats d’un changement en position 2‑hydroxyl sont imprévisibles et que le seul moyen de vérification est l’essai :
[traduction]
Q. Merci, M. Seeger. Vu la sensibilité qui existe au cycle glucidique et, comme vous l’avez mentionné, à la position 2’, quelle serait la conclusion du virologue versé dans son art quant à la question de savoir s’il est possible d’établir un fondement factuel ou une prédiction valable si une modification est apportée au cycle glucidique?
R. Comme je l’ai dit, il n’y a aucun moyen de prédire le résultat. Vous devez faire l’expérience et voir quelle est l’activité du composé en question.
(iii) L’avis de M. Patterson concernant la prévisibilité de l’activité
[355] Idenix n’a pas hésité à solliciter l’avis de M. Patterson sur la question de la prédiction de l’activité, bien qu’il n’ait pas été appelé comme expert et que le sujet n’ait pas été abordé dans sa déclaration de témoin. Gilead s’est opposée à cette déposition, que j’ai néanmoins autorisée. J’ai conclu que la preuve présentée par M. Patterson, comme celle qui l’a été par M. Stuyver, à laquelle Idenix s’est opposée par la suite, était pertinente parce qu’elle provenait de quelqu’un qui avait pris une part active aux événements survenus il y a longtemps, plutôt que d’experts se prononçant sur ces événements une décennie plus tard.
[356] Les extraits importants de la déposition de M. Patterson sont les suivants :
[traduction]
Q. Et pour quelle raison étiez‑vous raisonnablement optimiste?
R. Bien, nous avons remplacé un hydroxyle par le fluor. Ils sont d’une taille et d’une forme semblables, ils ont une structure électronique similaire et, vous savez, si, vous savez, je pense qu’il est raisonnable de s’attendre à ce qu’il soit actif.
[…]
Q. Et d’autres personnes ont substitué l’hydroxyle par un fluor?
R. Oui. M. Watanabe était assez célèbre pour faire ça.
Q. Et pourquoi une telle chose aurait‑elle été faite?
Me MARKWELL : Objection [déjà tranchée].
LE TÉMOIN : Bien, nous aimons parler d’isostères en chimie médicinale. Je préfère le terme « bioisostères », mais c’est un concept similaire. Donc, si vous avez une molécule biologique, disons un peptide ou un amide, vous avez ces structures similaires mais non nécessairement identiques, mais dont la taille, la forme et la structure électronique sont similaires; très souvent, pas toujours mais très souvent, ils sont acceptés par les systèmes biologiques. [page 1780]
[357] Idenix s’appuie aussi sur le témoignage de M. Patterson, qui dit que le fluor en position 2’ (bas) serait son [traduction] « premier choix » pour la création d’un analogue du composé d’Idenix, ce qui est la façon dont Pharmasset a décrit le produit de départ. Je fais observer que le premier choix pour une réaction chimique n’est pas la preuve d’une prédiction valable, mais je tiens aussi compte de cet aspect du témoignage, qui est proche de celui de M. Damha au sujet du caractère suffisant de la description de la synthèse.
[358] La déposition de M. Patterson concernant la prédiction de l’utilité était plus nuancée que ne le prétend simplement Idenix. Il y est allé d’un long discours sur les problèmes que pose la prédiction des résultats des analogues nucléosidiques en général.
[traduction]
LE TÉMOIN : Donc, dans ce contexte, j’étais optimiste, mais je ne partageais pas sa certitude absolue.
LE JUGE ANNIS : Parce qu’il y a des problèmes avec les nucléosides?
LE TÉMOIN : Oui, monsieur le juge, un nucléoside doit être un substrat de systèmes enzymatiques multiples, d’où la très grande difficulté de prédire si un nucléoside particulier sera actif. Il s’agit en effet de promédicaments, et ils doivent donc être transportés, habituellement transportés dans la cellule et ensuite, vous savez, convertis en monophosphate, puis ensuite en diphosphate et en triphosphate à quelques exceptions près. Et c’est le triphosphate qui est le métabolite actif. Ainsi, à cause de tous ces systèmes enzymatiques, ce n’est pas comme si vous aviez affaire à un seul système où la prédiction est bien plus facile, n’est‑ce pas?
[…]
LE TÉMOIN : D’accord, donc, une des façons pour nous, chimistes médicinaux, de voir si une molécule, une molécule active fonctionne contre une cible unique ou des cibles multiples est de nous poser la question suivante : cette molécule présente‑t‑elle une relation structure‑activité discernable? Pouvons‑nous, avec quelques molécules actives, prédire l’activité, vous savez, d’analogues, seront-ils plus ou moins actifs?
[…]
LE TÉMOIN : Les nucléosides font rarement cela. Et c’est parce qu’ils doivent agir, qu’ils doivent être activés par au moins trois enzymes pour donner le métabolite actif, et ce dernier doit ensuite être un substrat pour la polymérase virale. Donc, dans ce contexte, j’étais optimiste, mais je ne partageais pas sa certitude absolue.
[Non souligné dans l’original.]
[359] M. Patterson reconnaît d’ailleurs en quelque sorte le raisonnement borné du chimiste médical lorsqu’il déclare ce qui suit dans son témoignage :
[traduction]
Je dis souvent que ce que les chimistes organiques comprennent le mieux est la structure, certains prétendent qu’ils ne comprennent que la structure, et je pense que c’est ce dont nous avons besoin, des structures sur un tableau ou quelque chose comme ça.
[360] Il y avait très peu de données relatives à la molécule 2’‑C‑Me/OH pour qu’on puisse dire avec assurance qu’elle présentait une relation structure‑activité discernable, aspect rarement abordé dans les témoignages des témoins. Il n’y avait pas non plus de molécules actives dont on ait parlé pour prédire l’utilité du composé 2’‑C‑Me/F.
[361] Toutefois, la grande difficulté que soulève dans mon esprit le témoignage d’expert de M. Patterson est qu’il n’aborde pas l’aspect du témoignage de M. Seeger qui concerne la sélectivité de la position 2’ (bas) sur l’ARN et l’ADN et la question connexe de la toxicité des fluors. M. Patterson a évoqué la difficulté de prédire les résultats des nucléosides en général. Il n’aborde pas la question de savoir dans quelle mesure son optimisme aurait dû être tempéré à l’idée de réaliser une substitution à la position la plus conservée et la plus sélective en biologie chimique. Il ne tient pas non compte de la question de la toxicité fréquente du fluor. En toute équité, il n’a pas été appelé à formuler ces avis.
(iv) L’avis de M. Stuyver concernant l’imprévisibilité de la toxicité et de l’activité du composé fluoré
[362] Appelé à témoigner par Idenix, M. Stuyver s’est aussi prononcé en contre‑interrogatoire sur la prévisibilité de l’activité antivirale du nouveau composé doté d’un fluor en position 2’ (bas) avant sa synthèse :
[traduction]
Q. Conviendriez‑vous que, si vous prenez la structure numéro 3 de cette page, lorsque vous entreprenez une synthèse, il est possible de dire en regardant cette structure qu’elle agira comme un antimétabolite [pouvant avoir un effet toxique sur les cellules]?
R. Je ne suis pas sûr de comprendre votre question. Vous me demandez si, en regardant cette molécule, cette structure, il est possible de prédire s’il s’agira d’un antimétabolite; est‑ce votre question?
Q. Oui.
R. Vous ne le pouvez pas.
Q. Croyez-vous que, au début de 2003, en regardant cette structure, vous auriez pu dire si le médicament serait un candidat comme antiviral direct?
R. Mais au début de 2003, ce n’était pas un médicament, n’est‑ce pas? Et en 2003 vous faites, et en 2002, vous faites des plans, des hypothèses, vous faites des synthèses et des essais. Mais vous ne pouvez pas dire que – à ce moment‑là, vous ne pouvez pas dire que ce sera un antiviral ou un antimétabolite. [pages 3998 et 3999]
[Non souligné dans l’original.]
[363] Idenix cite les propos de M. Stuyver dans un article de 2004, après que les nucléosides 2’‑C‑Me/F eurent été synthétisés, où il dit que [traduction] « le fluor est un isostère du groupe hydroxyle » et que l’activité antivirale prédite à la suite de cette substitution est la suivante :
[traduction]
Comme le FdC [l’invention] est un analogue de la cytidine et que le fluor est un isostère du groupe hydroxyle, il est à prévoir que son 5’‑triphosphate inhibera l’ARN polymérase ARN-dépendante NS5B du virus.
[364] Si cet énoncé a pour but de montrer que M. Stuyver s’est ravisé au sujet de l’incapacité de prédire le résultat de l’antiviral avant l’essai du nouveau nucléoside 2’‑C‑Me/F, je conclus que c’est prouver l’avantage du recul que de parler publiquement d’une invention dont le locuteur prétend avoir été lui-même l’auteur et d’affirmer en outre avoir guidé le chimiste inventeur vers la fabrication du composé. Je préfère attribuer le sens de [traduction] « supposition éclairée » au terme [traduction] « à prévoir » dans le passage cité. Cet article n’a pas été présenté à M. Stuyver à des fins de confirmation, bien que celui‑ci ait été appelé à témoigner au nom d’Idenix et qu’il ait formulé l’opinion ci‑dessus au sujet de l’impossibilité de prédire l’utilité des nouveaux composés sans les mettre à l’essai.
d) La cytotoxicité des fluors
[365] Je conclus aussi qu’il n’existait aucune distinction quant à l’incapacité de prédire si un nouveau composé fluoré serait toxique à la position 2’ (haut) ou (bas) de l’analogue nucléosidique de l’ARN. À cet égard, Gilead fait également remarquer que les inventeurs savaient, d’après un brevet accompagnant le brevet 191 et déposé à la même date, le 23 juin 2003, qu’un décès était survenu récemment lors d’essais d’un composé appelé FIAU. Il s’agissait d’un composé portant un fluor en position 2’. Ce fait ne figurait pas dans le brevet 191. Le professeur La Colla connaissait les problèmes de toxicité que posaient le FIAU et d’autres composés 2’‑fluoro.
[366] Vu la preuve de l’imprévisibilité de la toxicité des composés fluorés, je conclus que c’était là un autre facteur faisant en sorte qu’il était impossible de prédire la toxicité des nouveaux composés fluorés sans les mettre à l’essai.
e) Alcon/moxifloxacine
[367] Pour finir, je suis invité à considérer la décision récente du juge Phelan dans l’affaire Alcon/moxifloxacine, qui, selon Idenix, s’applique aux faits de la présente affaire et devrait être suivie. Je ne suis pas de cet avis. Il existe une grande distinction entre les faits de la décision Alcon/moxifloxacine et les nouvelles circonstances présentées en l’espèce.
[368] Le brevet 114 revendiquait une classe de quinolones comprenant la moxifloxacine, et caractérisée par la présence d’un bicycle pyrrolidine fusionné en position C‑7 du noyau quinolone.
[369] La structure du noyau des quinolones est la suivante :
[370] La demanderesse prétendait que l’utilité d’un composé dans lequel le fluor en position C‑8 est substitué par un méthyle pouvait être valablement prédite, même s’il n’avait pas été synthétisé à la date du dépôt.
[371] La demanderesse avançait que le fait que les composés dotés d’un groupe méthoxy en position C‑8 étaient actifs faisait partie des connaissances générales courantes. La demande de brevet européenne no 0 241 06 (Sankyo) et le brevet européen no 0 230 295 A2 (Kyorin) étaient des exemples d’antériorités enseignant que les composés ayant cette caractéristique présentaient une bonne activité. La Cour a estimé que les inventeurs pouvaient donc valablement prédire que la substitution du fluor par un groupe méthoxy en C‑8 dans l’exemple cité dans le brevet améliorerait ou ne nuirait pas à l’activité antibactérienne élevée démontrée dans l’exemple.
[372] La distinction la plus évidente entre l’affaire Alcon/moxifloxacine et la présente tient à ce que les composés dotés d’un groupe méthyle en position C‑8 avaient déjà été synthétisés et s’étaient révélés actifs lors des essais. Il est évident que, au moment du dépôt, ni Idenix ni aucune autre organisation vouée à la découverte de médicaments n’avaient en leur possession des données d’essai sur les nucléosides 2’‑C‑Me/F ou sur des composés comparables auxquels un fluor en position 2’ (bas) conférait une activité, sauf Gilead, qui n’était pas connu par ailleurs à l’époque.
[373] Une autre distinction de taille entre les deux affaires est qu’il est impossible de comparer, sur le plan du résultat prédit, un composé de base hautement substitué qui existait depuis 1960 avec un autre composé dans lequel le groupe le plus sélectif et le plus hautement conservé dans un composé biologique avait été substitué pour la première fois par un élément connu pour sa toxicité.
[374] Dans la décision Alcon/moxifloxacine, la Cour traitait d’un composé de base dont l’utilité était démontrée depuis 1960 par son administration aux humains. Ce n’était pas un composé totalement nouveau, comme le nucléoside 2’‑C‑Me/OH, qui n’en était qu’au premier stade des essais cliniques et dont l’utilité restait à établir entièrement (et qui a fini par être retiré). La présente affaire peut donc être distinguée sans peine de l’affaire Alcon/moxifloxacine.
f) Le dernier mot sur l’arrêt Wellcome/AZT
[375] J’estime que les observations formulées par le juge Binnie, aux paragraphes 63 et 64 de l’arrêt Wellcome/AZT, sont extrêmement pertinentes lorsqu’il souligne la distinction entre la prévisibilité des réactions chimiques et celle des effets pharmacologiques, et donc de l’utilité pharmacologique de nouvelles substances :
63 La Cour d’appel fédérale a subséquemment appliqué la règle de la « prédiction valable » dans le contexte d’un brevet pour un produit pharmaceutique, dans l’arrêt Ciba‑Geigy Ag. c. Canada (Commissaire des brevets), [1982] A.C.F. no 425 (QL). Dans cet arrêt, le juge en chef Thurlow a confirmé la validité de revendications concernant des produits et des procédés se rapportant à certaines « nouvelles amines » utiles pour traiter les maladies cardiaques, mais il a formulé la réserve selon laquelle il se peut que ce qui est prévisible sur le plan chimique ne le soit pas sur le plan pharmacologique (au par. 8) :
Il me semble que la prévisibilité d’un résultat donné soit essentiellement une question de fait, même si dans certains cas ce peut être une question de notoriété publique. En ce qui concerne les réactions chimiques, ce qui précède indique clairement que la connaissance qu’ont les chimistes de la prévisibilité des réactions chimiques a fait d’immenses progrès au cours des cinquante années qui ont suivi la décision Chipman Chemicals Ltd. v. Fairview Chemicals Co. Ltd., [1932] R.C. de l’É. 107. Cependant, il ne faut pas confondre la prévisibilité des réactions chimiques et la prévisibilité des effets pharmacologiques et de l’utilité pharmacologique des nouvelles substances. [Souligné par le juge Binnie.]
64 Le juge en chef Thurlow n’établissait pas une règle de droit voulant que l’utilité pharmacologique ne soit pas prévisible parce que, comme il l’a dit, la prévisibilité est « essentiellement une question de fait ». Tout dépendra de la preuve. Par exemple, dans l’arrêt Beecham Group Ltd. c. Bristol Laboratories International S.A., [1978] R.P.C. 521 (H.L.), les revendications concernant une pénicilline semi‑synthétique ont été invalidées parce qu’elles n’étaient guère plus que l’annonce d’un projet de recherche (p. 570). Dans cette affaire, lord Diplock a affirmé, à la lumière des faits, à la p. 579 :
[traduction] En l’espèce, il existe une preuve accablante qu’il n’est pas encore possible de prédire quels seront, le cas échéant, les avantages thérapeutiques particuliers que présentera une pénicilline fabriquée selon une formule particulière. Le seul moyen de le savoir est de la fabriquer et de découvrir ses caractéristiques thérapeutiques en la soumettant à des tests in vitro et in vivo poussés.
[376] J’estime que la preuve devient presque irréfutable quant à l’impossibilité de valablement prédire les avantages thérapeutiques du remplacement de l’hydroxyle par un fluor dans le nucléoside 2’‑C‑Me/OH. Je conviens avec MM. Seeger et Stuyver et, implicitement, avec les chimistes d’Idenix à leur rencontre de Maui que le seul moyen de vérifier la valeur thérapeutique du nucléoside 2’‑C‑Me/F était de le fabriquer et d’en découvrir les caractéristiques thérapeutiques au moyen d’essais fiables et valides. C’est ce que Gilead a fait et ce qu’Idenix n’a pas fait.
4) Conclusion quant à la prédiction valable de l’utilité du composé 2’‑C‑Me/F
[377] Pour tous les motifs qui précèdent, j’estime que Gilead a démontré qu’Idenix ne pouvait prouver ni valablement prédire comme un fait inféré ou une inférence prima facie raisonnable l’utilité du nucléoside 2’‑C‑Me/F le 27 juin 2003 en tant que traitement efficace contre le VHC.
C. La divulgation des prédictions valables de l’utilité dans le brevet
1) L’exigence de divulguer l’utilité pour les inventions liées à une nouvelle utilisation
[378] Les parties ne s’entendent pas sur l’exigence de divulguer le fondement factuel et le raisonnement étayant la prédiction valable dans le brevet, telle qu’elle est énoncée dans la jurisprudence. S’appuyant sur l’analyse du juge Binnie, tel était alors son titre, dans la décision AstraZeneca/Pregabalin, Idenix limite l’exigence de la divulgation de l’utilité valablement prédite aux inventions liées à une « nouvelle utilisation ».
[379] Gilead fait valoir que la décision AstraZeneca/Pregabalin et l’arrêt ultérieur de la Cour d’appel fédérale Bell Helicopter Textron Canada Limitée c Eurocopter Société, 2013 CAF 219 (Bell Helicopter), laissent une certaine marge de manœuvre. Je ne pense pas que le raisonnement du juge Rennie laisse grand‑chose à deviner quant à la nécessité de divulguer l’utilité dans le cas d’une invention portant sur un « nouveau composé ». Il déclare au paragraphe 158 de la décision AstraZeneca/Pregabalin « [avoir dû se] [non souligné dans l’original] plier aux remarques de la Cour suprême dans l’arrêt Teva sildénafil ainsi qu’à l’interprétation de l’arrêt [Wellcome/]AZT approuvée par la juge Gauthier dans l’arrêt [Apotex Inc c Sanofi‑Aventis, 2013 CAF 186 (CanLII), paragraphe 42 (Sanofi‑Aventis Plavix)] ».
[380] J’adopte le raisonnement du juge Rennie, qui me paraît refléter fidèlement la jurisprudence contraignante pour la Cour. Par conséquent, dans la mesure où le brevet 191 se rapporte à la prédiction valable d’une nouvelle composition, il n’existe aucune exigence de divulgation de l’utilité. Je présume que cette dispense de divulgation s’applique à la fois au fondement factuel et au raisonnement.
[381] Même si j’ai conclu qu’Idenix n’est pas tenue de divulguer le fondement factuel de sa prédiction valable de l’utilité, je dois néanmoins décider si sa divulgation était suffisante au cas où le droit en cette matière évoluerait, puisqu’il est vrai qu’il est contesté : Pfizer Canada Inc c Pharmascience, 2013 CF 120, au paragraphe 157; AstraZeneca/Pregabalin (laquelle est en appel).
2) Les connaissances générales courantes relatives à la divulgation de l’utilité
[382] Dans la jurisprudence, il est reconnu qu’il n’est pas nécessaire de divulguer l’ensemble ou une partie des éléments d’une prédiction valable s’il s’agit de connaissances générales courantes. Cela s’applique à la fois à la divulgation du fondement factuel et du raisonnement. Le droit en cette matière a été décrit par le juge Noël, tel était alors son titre, dans l’arrêt Bell Helicopter, aux paragraphes 153 à 155 :
[153] Lorsqu’on peut trouver le fondement factuel dans des règles ou des principes scientifiques reconnus ou dans ce qui constitue les connaissances générales courantes de la personne versée dans l’art, il pourrait ne pas être nécessaire de divulguer ce fondement factuel dans le mémoire descriptif. À l’inverse, lorsque le fondement factuel repose sur des données qui ne font pas partie des connaissances générales courantes, il se peut fort bien que la divulgation dans le mémoire descriptif soit exigée pour étayer une prédiction valable.
[154] En l’espèce, l’idée originale de l’invention est décrite dans le brevet 787 comme étant une géométrie particulière (une traverse avant décalée et inclinée, ainsi qu’une zone de transition intégrée) qui crée un porte‑à‑faux, permettant à la traverse avant de travailler en mode flexion et en mode torsion : motifs, par. 300. De plus, le mémoire descriptif du brevet est suffisamment explicite pour permettre à une personne versée dans l’art de comprendre le fonctionnement général de l’invention et ses principales caractéristiques : motifs, par. 322.
[155] Par conséquent, lorsque la prédiction valable est fondée sur des connaissances faisant partie des connaissances générales courantes et sur un raisonnement qui semblerait évident à une personne versée dans l’art (ce qui est souvent le cas pour les inventions mécaniques), les exigences en matière de divulgation pourraient facilement être remplies simplement en décrivant l’invention de façon suffisamment détaillée pour en permettre la réalisation. Il convient donc d’adopter une approche contextuelle dans chaque cas.
3) La divulgation d’Idenix est‑elle adéquate?
[383] En dehors de tout recours aux connaissances générales courantes et en supposant qu’une divulgation est nécessaire, la question ici est de savoir si le brevet 191 décrit un fondement factuel et un raisonnement valable pour une prédiction valable de l’activité antivirale du nucléoside 2’‑C‑Me/F. Comme Gilead s’est concentrée sur la divulgation du fondement factuel des essais des nucléosides 2’‑C‑Me/OH en tant que substituts du VHC, je me limiterai dans mes observations à cette même question. Tout se ramène à la question de la divulgation par Idenix de ses données d’essai du nucléoside 2’‑C‑Me/OH comme partie du fondement factuel, ainsi que comme fondement factuel pour revendiquer que le VDVB et certains essais puissent être utilisés comme substituts pour démontrer l’activité contre le VHC.
a) La divulgation du fondement factuel des données d’essai d’Idenix sur le composé Me/OH
[384] Idenix prétend avoir divulgué les données d’essai dans le brevet 191 dans les exemples 25 et 26 et en renvoyant à ses demandes antérieures au titre du PCT nos WO 01/09121 (la demande 121) et WO 01/92282 (la demande 282).
(i) Les exemples 25 et 26
[385] Exemple 25 : S’il décrit divers essais, dont ceux pouvant servir à évaluer l’activité du composé contre un virus donné, l’exemple 25 n’offre pas de données à ce sujet.
[386] Exemple 26 : L’exemple 26 présente des données expérimentales relatives au composé F. Gilead fait valoir que ce composé n’est pas visé par les revendications et que les données sont lacunaires.
[387] La structure du composé F n’est pas divulguée dans le brevet 191. De plus, les revendications d’Idenix sont fondées sur les composés NM107 et NM283, qui n’avaient pas été rendus publics. Ajoutons que le composé F n’est pas le composé utilisé par Idenix comme fondement de ses revendications dans le brevet 191. Il comporte une base tricyclique non naturelle et hautement modifiée. La structure du composé F comparativement au composé NM107 d’Idenix est décrite ci‑dessous. Les données relatives au composé F ne sont pas dûment divulguées et ne s’appliquent donc pas au nucléoside 2’‑C‑Me/F.
[388] Les données de l’exemple 26 sur le composé F étaient présentées en deux tableaux superposés :
[389] Les tableaux comportent des problèmes évidents. La formule chimique est donnée, mais sans qu’on présente la structure nécessaire pour comprendre les propriétés stéréochimiques autour desquelles s’articule la relation structure‑activité.
[390] On dit des CE50 à la ligne du bas du premier tableau qu’elles proviennent d’essais faits en quadruple ou en triple. Elles sont exprimées en simples chiffres, alors qu’il devrait s’agir de moyennes ou d’écarts‑types. Qui plus est, le tableau ne décrit pas l’essai utilisé. Le mémoire descriptif décrit deux essais par lesquels on peut calculer le CE50 d’un composé, essais qui mesurent différents aspects de l’activité antivirale. Le virologue versé dans son art aimerait savoir quel essai a été réalisé afin de bien interpréter les données présentées. M. Seeger a affirmé que, faute de données expérimentales détaillées, le premier tableau ne livrait guère d’information utile. J’accepte son témoignage là‑dessus.
[391] Le deuxième tableau ne contient pas de titres à la ligne du haut. Les CE50 sont reprises des indications du premier tableau, alors qu’il est dit du deuxième tableau qu’il concerne les valeurs CC50 sur la toxicité. Il n’y a pas de précisions sur les lignées cellulaires, facteur d’importance si l’on considère que les valeurs varient selon les lignées. M. Seeger conclut que les tableaux de l’exemple 26 ne présentent pas clairement de données cytotoxicologiques correspondantes pour les lignées cellulaires employées dans les essais concernant l’activité antivirale. Il est donc impossible d’établir l’indice thérapeutique du composé F.
[392] Les opinions exprimées par M. Lamarre dans son rapport sur la question et son bref témoignage n’abordent pas la majorité des questions soulevées par M. Seeger. Plus précisément, M. Lamarre n’a pas contesté la conclusion de M. Seeger selon qui il était impossible d’établir l’indice thérapeutique du composé F.
(ii) La demande de brevet 949
[393] M. Lamarre s’est appuyé sur l’information de la demande de brevet 949, où les données d’essai d’Idenix étaient divulguées, pour démontrer l’activité antivirale de ses composés 2’‑C‑Me/OH. Cependant, Idenix a modifié sa demande de brevet 191, notamment en radiant le paragraphe d’introduction qui figurait en page 1, supprimant ainsi toute référence spécifique à la demande 949. Compte tenu de la suppression de ce paragraphe, la Cour ne voit aucune autre mention de la demande de brevet 949 dans le brevet 191. Je présume que c’est la raison pour laquelle Idenix n’a pas tenté d’invoquer les données contenues dans cette demande au cours des plaidoiries.
(iii) Les demandes 121 et 282
[394] Idenix soutient que les demandes précitées divulguent des données sur l’activité antivirale d’un certain nombre de nucléosides 2’‑C‑Me/OH contre le VDVB et le virus de la fièvre jaune. Gilead n’a pas fait d’observations au sujet des données d’essai dans ces demandes.
[traduction]
Idenix Pharmaceuticals décrit l’utilisation de nucléosides ramifiés dans le traitement contre les flavivirus (dont le VHC) et les pestivirus dans les publications internationales WO 01/90121 et WO 01/92282. Plus précisément, une méthode de traitement de l’infection par le virus de l’hépatite C (et les flavivirus et pestivirus) chez l’humain et d’autres animaux hôtes est divulguée dans les publications d’Idenix. Elle consiste en l’administration d’une quantité efficace d’un nucléoside ß‑D ou ß‑L ramifié en position 1’, 2’, 3’ ou 4’ biologiquement actif ou d’un de ses sels pharmaceutiquement acceptables ou dérivés, seul ou en association avec un autre agent antiviral, facultativement avec un excipient pharmaceutiquement acceptable.
[395] Dans ses arguments visant à contester le recours d’Idenix à la demande de brevet 949, Gilead a fait valoir que cette dernière n’avait pas le droit d’incorporer des données par renvoi puisque cela est explicitement interdit par le règlement pris en vertu de la Loi. Il se trouve qu’Idenix n’a pas invoqué la demande 949.
[396] Toutefois, la demande 282 décrit une activité des nucléosides 2’‑C‑Me/OH contre le VDVB et le virus de la fièvre jaune. M. Lamarre a présenté ces données d’essai dans son rapport de novembre 2014 :
[traduction]
En particulier, les composés 2’‑Me (haut), 2’‑OH (bas) ont été mis à l’essai avec les quatre bases naturelles contre les prototypes des genres Flavivirus (virus de la fièvre jaune) et Pestivirus (virus de la diarrhée des bovins). Un spectre d’activité antivirale est présenté aux pages 186, 190 et 191 de la demande WO 01/92282. Avec les données et les structures décrites dans cette demande, la personne versée dans l’art comprendrait que le principal aspect de cet analogue nucléosidique est le substituant 2’-Me (haut), puisque tous les autres substituants sont les mêmes que ceux d’un ribonucléoside naturel. Par ailleurs, d’après les données présentées, la personne versée dans l’art s’attendrait à une même activité contre d’autres Flaviviridae. Les données concernant l’activité contre le prototype des flavivirus et celui des pestivirus figurent au tableau ci‑après [qui n’est pas reproduit ici], et elles démontrent clairement l’activité antivirale des composés 2’-Me (haut), 2’‑OH (bas) :
[397] Je conclus que le brevet 191, par référence à la demande 282 et à son objet à cet égard, a suffisamment divulgué les données d’essai sur l’activité antivirale des nucléosides 2’‑C‑Me/OH contre les flavivirus (virus de la fièvre jaune) et les pestivirus (virus de la diarrhée virale des bovins). Toutefois, je ne suis pas d’accord avec M. Lamarre quand il fait remarquer que [traduction] « d’après les données présentées, la personne versée dans l’art s’attendrait à une même activité contre d’autres Flaviviridae », énoncé qui vise à inclure le VHC.
(iv) La divulgation du fondement factuel de la revendication d’utilisation possible du VDVB comme substitut pour démontrer l’activité contre le VHC
[398] Idenix n’a pas présenté ses données d’essai sur les chimpanzés dans le brevet 191. Elle aurait ainsi répondu à l’exigence d’une divulgation de ses données d’essai relatives au VHC. Il a déjà été noté qu’aucune donnée d’Idenix ne provient d’essais sur réplicon, données auxquelles le virologue versé dans son art se serait attendu en 2003 pour démontrer l’activité contre le VHC.
[399] Le brevet 191 décrit des similitudes génétiques et des similitudes de fonction des protéines entre les membres de la famille des Flaviviridae, et il précise à la page 2 que [traduction] « le virus de la diarrhée virale des bovins (VDVB) sert souvent de substitut pour l’étude du VHC » (non souligné dans l’original). À la page 3 du brevet 191, il est fait référence à l’article de Koonin et Dolja (1993) dont parle le professeur La Colla au sujet des motifs communs qui sont caractéristiques des ARN polymérases dirigées par l’ARN.
[400] Je ne juge toutefois pas que ces données suffisent à divulguer le fondement factuel d’une revendication de l’utilisation possible du VDVB comme substitut pour démontrer l’activité contre le VHC.
(v) Les connaissances générales courantes
[401] La question en l’espèce est de savoir si le défaut de divulgation de l’utilité dans le brevet peut être compensé par les connaissances générales courantes. Idenix propose la documentation suivante pour démontrer qu’en juin 2003, la possibilité d’utiliser le VDVB comme substitut adéquat dans les essais relatifs au VHC faisait partie des connaissances générales courantes.
1. Les diaporamas de Bhat et al., d’Eldrup et al. et d’Olsen et al. présentés à la 16e Conférence internationale sur la recherche antivirale (27 avril 2003, Savannah, en Géorgie)
[402] Ces documents, divulgués en page 10 du brevet 191 et décrits précédemment, consistent en un jeu de diapositives utilisées comme supplément visuel aux présentations orales. Celles‑ci n’ont eu lieu qu’un peu plus de deux mois avant la date de la demande, soit le 27 juin 2003.
[403] M. Seeger déclare dans son rapport de décembre que les diaporamas provenant de conférences scientifiques ne sont habituellement pas publiés et que le virologue versé dans l’art n’en recevrait ordinairement pas copie. Compte tenu seulement des informations fournies dans le brevet 191, un virologue versé dans l’art n’aurait pas su si les résumés d’articles avaient été publiés et aurait eu à effectuer une recherche dans les publications pour le savoir. Aussi, M. Seeger fait remarquer que les résumés publiés ne fournissent ni données, ni structures, ni informations quant à la nature des nucléosides mis à l’essai. Quoique certains résumés de présentations puissent être publiés dans des bulletins d’information sur la conférence ou des ouvrages rassemblant les résumés publiés à cette occasion, les informations pouvant être glanées à partir d’un résumé sont limitées et ne sont soumises à aucune évaluation par des pairs. Dans ce cas, la seule information donnée est que [traduction] « des analogues nucléosidiques modifiés en position 2’ » avaient présenté une activité antivirale dans les essais sur réplicon du VHC.
[404] Les résumés joints au programme de la conférence n’étaient d’aucune aide, puisqu’ils mentionnaient seulement que des analogues nucléosidiques non divulgués modifiés en position 2’ avaient inhibé la synthèse de l’ARN viral dans un essai cellulaire sur réplicon sans causer de cytotoxicité, et rien d’autre de pertinent.
[405] Idenix n’a pu fournir aucun élément de preuve de quelque importance que ce soit sur la disponibilité des documents, sous forme de détails quant à la date ou aux circonstances dans lesquelles elle a reçu une copie des diaporamas, ou quant à leur disponibilité générale aujourd’hui, dix ans plus tard. En dehors du fait qu’ils se trouvent maintenant en sa possession, rien n’indique que les résumés d’articles avaient été transmis à Idenix. La personne ayant assisté à la conférence, M. Storer, n’a pas été appelée à témoigner. Il a envoyé un courriel à M. Standring, mais sans y joindre de pièces. Je soupçonne que la seule personne qui aurait pu offrir une déposition sur la réception ou le caractère public de ces documents était M. Storer.
[406] J’accepte la preuve de M. Seeger selon laquelle les données présentées oralement et basées sur les diaporamas de Savannah n’ont pas été distribuées, mais mentionnées dans le brevet 191, et conclus que ces informations ne satisfont pas à l’exigence du paragraphe 81(2) à titre de documents rendus publics le 27 juin 2003. J’estime aussi qu’ils ne font pas partie des connaissances générales courantes, que ce soit à l’égard de leur contenu, de la date de leur publication ou de la preuve relative à leur acceptation générale.
[407] Comme il n’existe pas de documents publics qui présentent le fondement factuel selon lequel les essais sur le VDVB peuvent constituer des essais substitutifs pour démontrer l’activité contre le VHC, le brevet 191 ne divulgue aucun élément clé d’un fondement factuel permettant une prédiction valable d’utilité. Idenix n’a pas tenté d’établir que les essais sur le VDVB comme essais substitutifs pour le VHC relevaient des connaissances générales courantes, et il n’existe aucun élément de preuve en ce sens.
2. L’article de Carroll et al.
[408] Cet article n’est pas mentionné dans le brevet 191. Rien n’indique non plus que son contenu était « connu de manière générale et accepté » par une majorité de ceux qui travaillent dans le domaine. L’article de Carroll a plutôt été publié le 4 avril 2003, moins de trois mois avant le dépôt du brevet 191. Par ailleurs, le simple fait qu’un article soit publié ne suffit pas à établir qu’il faisait partie des connaissances générales courantes. Même si j’ai admis le document parce que le professeur La Colla en avait connaissance, il n’en demeure pas moins qu’aucun document contemporain émanant des inventeurs n’établit que cet article était connu et accepté de la personne versée dans l’art comme faisant partie des connaissances générales courantes. Je conclus qu’il n’en faisait pas partie.
[409] La Cour conclut que l’information portant que le VDVB représentait un substitut adéquat pour les essais relatifs au VHC ne faisait pas partie des connaissances générales courantes en juin 2003.
b) La divulgation du raisonnement valable fondant la prédiction
[410] Gilead n’a pas contesté l’absence de divulgation du raisonnement valable invoquée par Idenix sur la base de l’analogie stérique du groupe hydroxyle et du fluor dans une substitution. Par conséquent, je me prononcerai une autre fois sur la question de savoir si une référence aussi brève que celle qui se trouve en page 10 du brevet 191 à la demande de brevet Emory pourrait constituer une divulgation suffisante d’un raisonnement sur l’analogie stérique.
[traduction]
La publication PCT no WO 99/43691 de l’Université Emory intitulée « 2’‑Fluoronucleosides » divulgue l’utilisation de certains 2’‑fluoronucléosides dans le traitement contre le VHC.
[411] Le passage mentionné dans la demande de brevet Emory est le suivant :
[traduction]
Dans la conception de nouveaux nucléosides biologiquement actifs, il y a eu un certain nombre de tentatives d’incorporer un substituant fluor au cycle glucidique du nucléoside. Le fluor a été proposé comme substituant parce qu’il pourrait servir d’analogue isopolaire et [15] isostérique d’un groupe hydroxyle, car la liaison C‑F est d’une longueur (1,35 Å) à peu près égale à celle de la liaison C‑O (1,43 Å) et le fluor est un accepteur de liaisons hydrogène. Le fluor peut produire d’importants changements électroniques dans une molécule en n’entraînant qu’une perturbation stérique minime. La substitution par un fluor d’un autre groupe dans une molécule peut modifier le métabolisme du substrat à cause de la grande force de la liaison C‑F (116 kcal/mol contre 100 kca/mol pour la liaison C‑H).
c) Conclusion
[412] La Cour conclut qu’Idenix n’a pas présenté de prédiction valable de l’utilité du nucléoside 2’‑C‑Me/F, n’ayant pas divulgué de fondement factuel pour son avis exprimé en juin 2003 que les nucléosides 2’‑C‑Me/OH avaient une activité contre le VHC.
VIII. Le caractère suffisant de la divulgation de la synthèse de l’invention
A. Introduction et principes juridiques
1) Introduction
[413] La principale question qui occupe presque l’ensemble de l’analyse de cette section est de savoir si le brevet 191 divulgue suffisamment comment fabriquer le nucléoside 2’‑C‑Me/F. Je conclus que Gilead a établi que le brevet 191, complété par les connaissances générales courantes, ne le fait pas.
[414] Cette conclusion tient compte de l’ensemble des arguments présentés par Idenix et repose sur mes conclusions factuelles, notamment le fait que j’ai préféré la déposition des experts de Gilead à celle des experts d’Idenix. Il n’est donc pas nécessaire pour la Cour d’examiner l’argument d’Idenix selon lequel la divulgation habilitante de la synthèse des nucléosides 2’‑C‑Me/OH relativement au critère de l’antériorité selon l’article 28.1 est la même que la divulgation de la manière de fabriquer le composé selon l’alinéa 27(3)b) de la Loi.
[415] Gilead fait également valoir, à titre d’argument préliminaire, que, selon la revendication 1 du brevet 191, et en considérant toutes les revendications comme une seule invention, l’invention n’a pas été divulguée puisqu’il était impossible d’en trouver une seule qui aille à l’encontre des exigences énoncées par la Cour suprême du Canada dans l’arrêt Viagra. Je rejette cet argument et conclus que l’arrêt en question ne s’applique pas aux faits de la présente affaire.
2) Les principes juridiques
a) Les exigences de divulgation
[416] La divulgation est un aspect important du marché passé entre l’inventeur et le public. Il s’agit de la contrepartie aux droits précieux de propriété exclusive qui sont une pure création de la Loi sur les brevets. En échange du monopole, l’inventeur doit fournir au public une description adéquate de l’invention comprenant des détails suffisamment complets et précis pour permettre à un travailleur versé dans l’art auquel l’invention s’adresse de l’interpréter ou de l’utiliser : Wellcome/AZT, au paragraphe 37.
[417] La Cour suprême du Canada a décrit les éléments essentiels de la divulgation dans l’arrêt Pioneer Hi‑Bred Ltd c Canada (Commissaire des brevets), [1989] 1 RCS 1623, aux pages 1637, 1638 et 1641, (Pioneer Hi‑Bred), avec omission des renvois :
Les tribunaux canadiens ont eu l’occasion d’énoncer au cours des années le test qu’il faut appliquer pour savoir si la divulgation est complète. Le demandeur doit divulguer tout ce qui est essentiel au bon fonctionnement de l’invention. Afin d’être complète, celle‑ci doit remplir deux conditions : l’invention doit y être décrite et la façon de la produire ou de la construire définie […]. Le demandeur doit définir la nature de l’invention et décrire la façon de la mettre en opération. Un manquement à la première condition invaliderait la demande parce qu’ambiguë alors qu’un manquement à la seconde l’invaliderait parce que non suffisamment décrite. Quant à la description, elle doit permettre à une personne versée dans l’art ou le domaine de l’invention de la construire à partir des seules instructions contenues dans la divulgation […], et d’utiliser l’invention, une fois la période de monopole terminée, avec le même succès que l’inventeur, au moment de sa demande […].
[…]
Pourtant, il est clair que mis à part les étapes qui apparaissent évidentes et de commune renommée pour l’expérimentateur versé dans la matière, la personne à qui s’adresse la divulgation [traduction] « n’est pas obligée de faire ou d’en connaître davantage, et si le mémoire descriptif contient quelque chose qui requiert la résolution d’un problème, la demande de brevet ne peut être maintenue » […].
[Non souligné dans l’original.]
[418] Pour ce qui est de décider si Idenix s’est conformée au paragraphe 27(3), la Cour suprême du Canada, aux paragraphes 50 et 51 de l’arrêt Viagra, énonce un cadre d’analyse du caractère suffisant de la divulgation sous la forme de trois questions qui doivent être élucidées :
a) Quelle est l’invention?
b) Comment fonctionne‑t‑elle?
c) La personne versée dans l’art qui dispose uniquement du mémoire descriptif peut‑elle réaliser l’invention en s’aidant uniquement des instructions contenues dans la divulgation?
[419] Ce cadre fait écho au libellé des alinéas 27(3)a) et b) de la Loi sur les brevets, qui disposent ce qui suit :
|
27. (3) Le mémoire descriptif doit : |
27. (3) The specification of an invention must
|
|
a) décrire d’une façon exacte et complète l’invention et son application ou exploitation, telles que les a conçues son inventeur;
|
(a) correctly and fully describe the invention and its operation or use as contemplated by the inventor;
|
|
b) exposer clairement les diverses phases d’un procédé, ou le mode de construction, de confection, de composition ou d’utilisation d’une machine, d’un objet manufacturé ou d’un composé de matières, dans des termes complets, clairs, concis et exacts qui permettent à toute personne versée dans l’art ou la science dont relève l’invention, ou dans l’art ou la science qui s’en rapproche le plus, de confectionner, construire, composer ou utiliser l’invention;
|
(b) set out clearly the various steps in a process, or the method of constructing, making, compounding or using a machine, manufacture or composition of matter, in such full, clear, concise and exact terms as to enable any person skilled in the art or science to which it pertains, or with which it is most closely connected, to make, construct, compound or use it; |
[420] Aucune partie n’a soulevé de question sur le fonctionnement de l’invention. La « nature » de l’invention doit être succinctement abordée si l’on considère l’interprétation de l’arrêt Viagra retenue par Gilead. À l’évidence, il s’agit surtout dans le cadre de cette section de décider si la divulgation est suffisante pour permettre au chimiste versé dans l’art de fabriquer le composé en s’aidant uniquement des instructions contenues dans la divulgation.
b) Les connaissances générales courantes et les essais courants
[421] J’ai déjà abordé certains aspects du droit en ce qui a trait aux connaissances générales courantes et aux essais courants. Il est reconnu que la personne versée dans l’art qui cherche à réaliser l’invention peut s’en prévaloir (Pioneer Hi‑Bred, page 1641, précité; Teva Canada Limited c Novartis AG, 2013 CF 141, au paragraphe 384.
[422] La position d’Idenix sur le recours à ces deux principes en l’espèce est sans doute la mieux résumée au paragraphe 371 de ses observations :
[traduction]
[371] […] En ce qui concerne le brevet 191, la personne versée dans l’art apprend comment fabriquer la molécule précurseur en vue de la fluoration. Pour cette étape, elle serait au fait des différents agents fluorants susceptibles d’être utilisés, et serait le plus attirée par le réactif le plus couramment utilisé pour convertir un alcool en fluorure, à savoir le DAST ou un réactif équivalent tel que le Deoxofluor. Même si les conditions de réaction n’étaient pas connues avec précision (puisque le composé revendiqué était nouveau), les élucider relèverait tout à fait de la gamme d’essais courants par tâtonnement auxquels devrait se livrer un chimiste versé dans l’art.
[Non souligné dans l’original.]
[423] J’ai déjà formulé des observations sur l’élargissement de ce qui constitue les connaissances générales courantes à l’âge informatique, en citant la juge Gauthier dans la décision Cefaclor, au paragraphe 104, que je reproduis ici :
La distinction entre les connaissances générales courantes et les réalisations antérieures qui font partie de l’état de la technique aux fins d’évaluer l’antériorité et l’évidence a tendance à diminuer de nos jours en raison de la complexité des engins de recherche et de l’accessibilité aux publications et aux bases de données électroniques.
[424] Idenix décrit en ces termes dans ses observations écrites finales les limites des connaissances générales courantes figurant dans les bases de données scientifiques :
[traduction]
Idenix ne pense pas que les connaissances générales courantes englobent toutes les informations contenues dans les bases de données Scifinder ou Beilstein Crossfire. La personne versée dans l’art devrait savoir quoi chercher avant que ces outils ne puissent lui être utiles. Cependant, si le chimiste versé dans l’art s’intéressait à une transformation spécifique, les résultats d’une recherche adéquate à cet égard revêtiraient pour lui une importance fondamentale.
[425] Il ne s’agit pas vraiment de la question en l’espèce, étant donné que les circonstances présentes décrivent plutôt une série de recherches et la nécessité d’effectuer des expériences relativement à chacune d’elles comme sous‑étape pour aller de l’avant. La présente affaire soulève la question de savoir si le résultat des recherches peut être considéré comme faisant généralement partie des connaissances générales courantes, ou, inversement, si une série de recherches exigeant des expériences pose trop de difficultés. Elle concerne aussi la question des éléments de preuve relatifs aux travaux accomplis par les chimistes pour synthétiser le composé pendant la période de 2002 à 2005.
c) Aucune étape inventive en jeu
[426] Les parties n’ont pas tenté de soulever la moindre question sérieuse concernant le fait qu’une étape inventive constituait un facteur entrant en jeu au moment d’invoquer les connaissances générales courantes ou des expériences posant trop de difficultés pour circonscrire les connaissances générales courantes ou les expériences. Il est évident par définition qu’une démarche qui suppose une étape inventive ne peut faire partie des connaissances courantes. De même, dans l’arrêt Plavix (CSC), la Cour suprême du Canada a spécifiquement exclu les expériences par tâtonnement qui venaient compléter une étape inventive. Le juge Rothstein, s’exprimant sur le rôle des expériences faisant appel à une étape inventive, a déclaré ce qui suit au paragraphe 33 :
[33] Après combien d’essais successifs conclut‑on au caractère non réalisable de l’invention déjà divulguée? Lorsque le juge de première instance conclut qu’une étape inventive était nécessaire pour parvenir à l’invention du deuxième brevet, le mémoire descriptif du premier brevet ne rend assurément pas l’invention réalisable. Cependant, même lorsque aucune étape inventive n’est nécessaire, la personne versée dans l’art doit tout de même être capable d’exécuter ou de réaliser l’invention du deuxième brevet sans trop de difficultés.
[Non souligné dans l’original.]
[427] Les experts des deux parties ont fait des déclarations contradictoires générales quant au caractère inventif ou non de la fabrication du composé, mais sans aller plus loin. M. Barrett prétend que l’étape de fluoration n’appelait aucune inventivité. Son avis sur la question figure au paragraphe 128 de son rapport de novembre :
[traduction]
[128] Je reconnais que, dans certains cas, la combinaison de réactions connues pourrait ne pas être habituelle, puisque la détermination de la séquence des étapes à suivre pourrait supposer une certaine inventivité. Ce n’est pas le cas ici. Dans la présente affaire, le brevet 191 décrit explicitement deux méthodes possibles de synthèse de molécules précurseurs appropriées. Une seule autre étape s’ajoute à ce qui est décrit dans le brevet 191 et cette étape, à savoir la substitution d’un alcool pour fournir un fluorure, aurait été simple pour la personne versée dans l’art, surtout qu’elle était amplement décrite dans les antériorités contemporaines.
[Non souligné dans l’original.]
[428] M. Damha exprime le même avis au paragraphe 106 de son rapport de septembre :
[traduction]
[106] J’estime qu’une personne versée dans l’art aurait été en mesure de préparer les composés visés par les revendications du brevet 657 en s’aidant de la divulgation du brevet 191, et ce, sans devoir faire preuve d’une ingéniosité inventive ni effectuer d’expériences posant trop de difficultés […]
[429] M. Wnuk, au paragraphe 198 de son rapport de novembre, se dit en désaccord avec M. Damha quant à sa déclaration de selon laquelle la préparation du composé 2’‑C‑Me/F ne faisait appel à aucune ingéniosité inventive (il n’a pas répondu au commentaire de M. Barrett, les deux rapports ayant été signifiés le même jour). Cependant, la question du caractère inventif de la synthèse du composé 2’‑C‑Me/F n’est pas élaborée dans le reste de la preuve. M. Wnuk ne souscrit tout simplement pas à la déclaration plus large des experts d’Idenix selon laquelle ni les connaissances générales courantes ni les expériences par tâtonnement ne sont suffisantes pour permettre à la personne versée dans l’art de savoir comment fabriquer le composé cible.
[430] Gilead préfère faire valoir que les publications et les connaissances du chimiste versé dans l’art à l’époque n’établissaient aucune connaissance générale courante quant à l’étape de fluoration. De plus, elle soutient que les étapes et procédures décrites par Idenix pour parvenir à la synthèse du composé 2’‑C‑Me/F supposeraient un fardeau indu en matière d’expériences. Elle s’appuie implicitement sur les observations formulées par le juge Rothstein dans l’arrêt Plavix (CSC), précité, au paragraphe 33, selon lesquelles « même lorsqu’aucune étape inventive n’est nécessaire, la personne versée dans l’art doit tout de même être capable d’exécuter ou de réaliser l’invention du deuxième brevet sans trop de difficultés » (non souligné dans l’original).
[431] À cet égard, je note que, lorsque le caractère inventif était en jeu dans l’arrêt Plavix (CSC), la Cour suprême a inclus au paragraphe 78 des « méthodes permettant [d’]obtenir [le composé] » comme aspect de « l’idée originale », ce qui équivaut selon moi à une étape inventive :
[78] En l’espèce, il est clair que l’idée originale à la base des revendications du brevet 777 est un antiplaquettaire à l’effet thérapeutique supérieur et à la toxicité moindre comparativement aux autres composés couverts par le brevet 875, et les méthodes permettant de l’obtenir.
[Non souligné dans l’original.]
[432] M. Damha était apparemment du même avis lorsqu’il a déclaré ce qui suit :
[traduction]
Il n’y a pas de magie. En réalité, la chimie, si je, et je dis ça respectueusement, c’est le caractère original du composé, son utilisation, la découverte, sa fabrication.
[Non souligné dans l’original.]
[433] Le concept d’étape inventive aurait pu s’avérer pertinent quant à l’issue de la présente décision s’il avait été soumis à la Cour sous forme de question à trancher. Il s’agit d’un premier moyen servant à circonscrire l’application des connaissances générales courantes et des expériences. Ce concept aurait aussi pu être soulevé relativement aux questions de contrefaçon pour corriger les caractéristiques essentielles au titre du « principe de l’arrêt Catnic » (Catnic Components Ltd c Hill & Smith Ltd, [1982] RPC 183, aux pages 242 et 243 (Catnic), tel qu’il a été approuvé par la Cour suprême du Canada dans les arrêts Free World et Whirlpool). Les étapes inventives sont également importantes pour décider qui est l’inventeur et s’il peut y avoir deux étapes inventives consistant à avoir eu l’idée du composé et à avoir réalisé l’invention.
[434] Les deux parties semblent avoir leurs propres raisons se rapportant à des questions différentes pour ne pas soulever le moindre argument faisant état d’une étape inventive, et elles ont clairement décidé de ne pas le faire. Je conviens que ce n’est pas nécessaire en l’espèce, étant donné que l’affaire peut être tranchée au moyen d’autres conclusions factuelles. Mais cette stratégie paraît inhabituelle à la Cour, étant donné que, dans la plupart des litiges, toutes les observations susceptibles de contribuer à un jugement final favorable sont normalement soumises.
d) Les observations de Gilead concernant l’insuffisance de la divulgation selon l’arrêt Viagra
[435] Par deux nouveaux arguments qu’elle soumet en deux places différentes de ses observations, Gilead tente sans succès d’appliquer l’arrêt Viagra de manière à faire déclarer le brevet 191 invalide. Ici, la question semble porter sur le caractère insuffisant de la divulgation à la lumière de l’arrêt Viagra, alors que plus loin, sous la rubrique [traduction] « Qu’est‑ce que l’invention? », Gilead soutient qu’il n’y a pas d’invention étant donné qu’Idenix n’a pas pu synthétiser tous les composés des revendications 1 à 3.
[436] Le fondement des deux arguments est décrit aux paragraphes 172 à 174 des observations de Gilead, que je reproduis ci‑après sans les notes de bas de page :
[traduction]
[172] La Cour a déclaré que, même s’il est possible que différentes revendications d’un brevet divulguent des inventions distinctes, « on ne peut se prononcer qu’à l’issue d’une analyse des faits propres à une affaire » et qu’elle doit examiner l’ensemble de la divulgation et des revendications pour établir la nature de l’invention et les méthodes pour la réaliser.
[173] La Cour a examiné tout le mémoire descriptif dans lequel le breveté a décrit « l’invention » comme une classe de composés. La Cour a estimé que rien ne confirmait que l’utilisation du sildénafil (revendication 7) représentait une invention distincte de celle des autres composés revendiqués. Aucun attribut ou caractéristique spécifique n’a été attribué au sildénafil qui l’aurait distingué des autres composés.
[174] Enfin, la Cour a considéré l’exigence statutaire selon laquelle chaque brevet ne doit porter que sur une seule invention, et l’absence de demande complémentaire déposée par Pfizer. La Cour a estimé que : « Pfizer ne saurait en toute honnêteté affirmer, d’une part, que la demande de brevet vise une seule invention aux fins de la conformité au par. 36(1), puis soutenir, d’autre part, que chacune des revendications correspond à une invention distincte pour les besoins du présent pourvoi ».
[437] Gilead soulève pour la première fois son argument sur le caractère suffisant de la divulgation aux paragraphes 175 à 177, dans lesquels elle cite le paragraphe 75 de l’arrêt Viagra (notes de bas de page omises) :
[traduction]
[175] Divulgation suffisante – Lorsqu’elle a conclu que le brevet ne décrivait pas suffisamment l’invention, la Cour suprême a formulé les observations importantes suivantes d’application plus générale :
[70] Je rappelle que, dans Consolboard, notre Cour statue clairement que le mémoire descriptif, constitué des revendications et de la divulgation, doit définir la « portée exacte et précise » du privilège revendiqué, de sorte que le public puisse, en n’ayant que le mémoire descriptif, utiliser l’invention de la même façon que l’inventeur (p. 520). J’estime que les juridictions inférieures interprètent mal Consolboard lorsqu’elles affirment qu’il suffit de répondre aux deux questions suivantes : « En quoi consiste votre invention? Comment fonctionne‑t‑elle? ». Le juge Dickson ne statue pas qu’il s’agit des seules questions pertinentes. Citant Minerals Separation, il ajoute en fait à la p. 520 :
Quant à chacune de ces questions, la description doit être exacte et complète de sorte que, …
[traduction] … une fois la période de monopole terminée, le public puisse, en n’ayant que le mémoire descriptif, utiliser l’invention avec le même succès que l’inventeur, à l’époque de la demande. [Je souligne.]
[C’est Gilead qui souligne.]
[71] La Cour reprend ce principe dans Pioneer Hi‑Bred : « Quant à la description, elle doit permettre à une personne versée dans l’art ou le domaine de l’invention de la construire à partir des seules instructions contenues dans la divulgation » (p. 1638).
[…]
[74] Le public ne pouvait, à partir de sa divulgation dans le mémoire descriptif, « utiliser l’invention avec le même succès que l’inventeur, à l’époque de la demande », car même si un lecteur versé dans l’art aurait pu déduire que le composé efficace correspondait aux revendications 6 et 7, il lui aurait fallu effectuer d’autres essais pour déterminer lequel des deux était véritablement indiqué pour le traitement de la DÉ.
[176] La Cour a spécifiquement rejeté l’argument de Pfizer selon lequel la divulgation était suffisante puisque des tiers avaient fini par recevoir suffisamment d’information pour utiliser l’invention :
Le fait que Teva a entrepris la recherche requise n’a pas d’incidence sur l’obligation de Pfizer de divulguer l’invention de manière complète. Il faut surtout se demander si le lecteur versé dans l’art est en mesure de mettre l’invention en pratique à partir du seul mémoire descriptif. De toute évidence, le juge de première instance conclut que le lecteur versé dans l’art doit se livrer à un minimum de recherche pour savoir quelle est la véritable invention.
[C’est Gilead qui souligne.]
[177] La Cour suprême a estimé que le brevet était insuffisant, car « le lecteur versé dans l’art ne saurait, à partir du seul mémoire descriptif, mettre l’invention en œuvre ». À titre de mesure de réparation, la Cour suprême a estimé que : « l’omission de divulguer convenablement l’invention et son fonctionnement doit en toute logique emporter l’invalidité réputée du brevet. Telle est la conséquence du caractère synallagmatique du marché qui intervient sous le régime de la Loi. Faute de l’un des deux contreparties (quid) — la divulgation suffisante — l’autre (quo) — le monopole — ne saurait exister. »
[Non souligné dans l’original.]
[438] J’avoue avoir du mal à suivre cet argument. La référence à « l’omission de divulguer convenablement l’invention et son fonctionnement » semble renvoyer aux deux premières questions posées dans l’arrêt Viagra. Le passage sur « le lecteur versé dans l’art ne [sachant], à partir du seul mémoire descriptif, mettre l’invention en œuvre » semble faire référence à la divulgation de la synthèse du composé. Idenix soutient que l’arrêt Viagra porte au fond sur la divulgation de l’invention et non sur la question de savoir si cette divulgation révèle suffisamment comment réaliser l’invention. Je n’arrive pas à faire la distinction entre les deux arguments dans l’arrêt Viagra, dans la mesure où la Cour suprême n’a semble‑t‑il jamais précisé sur quel alinéa (a) ou b)) du paragraphe 27(3) elle s’appuyait dans l’arrêt.
[439] De toute façon, je ne pense pas que cela soit important. J’estime que les parallèles sont insuffisants pour que l’arrêt Viagra s’applique en l’espèce. Dans cette affaire, l’invention était connue et l’inventeur était suffisamment capable de la décrite, mais le lecteur versé dans l’art était livré à lui‑même quant à la question de savoir laquelle des deux revendications contenait la divulgation exacte, ce qui rendait nécessaire un minimum de recherche pour le découvrir.
[440] Les faits en l’espèce sont sans rapport avec les faits de l’affaire Viagra, où il est clair d’après les revendications 1 à 3 et les revendications qui en dépendent que le fluor (bas) et le méthyle (haut) en position 2’ du cycle carboné représentent l’invention, même si la revendication 1 vise des millions de composés au bas mot. La question reste à savoir si la synthèse du nucléoside a été divulguée dans le brevet et relève des connaissances générales courantes et d’essais courants. Idenix soutient d’ailleurs que le lecteur versé dans l’art qui disposerait uniquement du mémoire descriptif serait en mesure de synthétiser l’invention du brevet en s’aidant des connaissances générales courantes complétées par des essais courants.
[441] La Cour suprême, dans l’arrêt Viagra, n’a pas convenu avec les tribunaux d’instances inférieures que les revendications portaient sur des inventions différentes. Gilead soutient qu’Idenix est revenue sur l’observation qu’elle avait soumise à l’OPIC selon laquelle les revendications 1 à 3 représentaient une seule invention en ne faisant pas valoir la revendication 1. Je ne vois pas sur quel fondement cette conclusion repose, ni pourquoi Idenix ne peut pas renoncer à la défense d’une revendication formulée en termes trop généraux. J'ai déjà renvoyé à l’arrêt Viagra, au paragraphe 80, à titre de précédent entérinant une telle pratique.
[442] Je n’accepte pas non plus que l’arrêt Viagra défende le principe voulant que l’idée de « minimum de recherche » décrive adéquatement le critère permettant de définir ce qui constitue « trop de difficultés » au moment de réaliser l’invention grâce à des essais courants. Les essais nécessaires dans l’arrêt Viagra avaient seulement pour objet de montrer que la divulgation de l’invention créait une ambiguïté entre deux possibilités, alors que l’ingrédient actif était connu et aurait dû être divulgué en premier lieu.
B. Qu’est‑ce que l’invention?
1) Le quasi‑accord sur la description de l’invention
[443] Dans l’arrêt Viagra, la Cour suprême du Canada affirme au paragraphe 53 que la première étape à suivre pour établir si les exigences en matière de divulgation ont été respectées consiste à définir la nature de l’invention :
[53] Pour déterminer si les exigences de divulgation sont respectées en l’espèce, il faut d’abord définir la nature de l’invention que vise le brevet 446. Cette démarche est nécessaire pour s’assurer de sa conformité au par. 27(3) de la Loi, qui exige notamment que le mémoire descriptif « décri[ve] d’une façon exacte et complète l’invention ». Il faut donc se demander en quoi consiste l’invention visée par le brevet 446.
[444] Jusqu’à un certain point, les parties conviennent généralement que l’invention dans le brevet 191 correspond à une classe de composés 2’‑C‑Me/F ayant une activité contre les Flaviviridae. L’observation écrite d’Idenix sur la nature de l’invention est la suivante :
[traduction]
[2] Quelle est l’invention en question? À la date de dépôt du 23 juin 2003, les inventeurs du brevet canadien 2 490 191 avaient fait une prédiction valable quant à l’activité contre les Flaviviridae d’une nouvelle classe de composés. Les composés de l’invention appartiennent à une classe d’analogues nucléosidiques qui présentent une modification particulière en position 2’ du cycle glucidique, à savoir un fluor en position (bas) et un méthyle en position (haut).
[445] L’avocat de Gilead a décrit en ces termes l’invention dans ses observations orales : [traduction] « Ici, l’invention vise les composés du groupe H, ainsi que ce que je vous ai montré il y a une minute dans l’arrêt Christiani c Rice, [1930] RCS 443, soit un moyen de réaliser ce qui est inventé avec utilité ».
[446] Idenix semble avoir mal compris la position de Gilead lorsqu’elle déclare accepter que l’inventeur n’est pas tenu d’avoir réalisé dans les faits un composé relevant des revendications.
[traduction]
Les deux parties conviennent qu’au titre du droit canadien, l’inventeur n’est pas tenu d’avoir réalisé dans les faits un composé relevant des revendications. En d’autres mots, les exigences liées à une « invention » ou à une idée originale ne devraient pas être confondues avec une fabrication réelle et physique d’un composé de l’invention.
[Non souligné dans l’original.]
[447] La confusion pourrait venir de ce à quoi Gilead faisait référence lorsqu’elle évoquait [traduction] « un moyen de réaliser ce qui est inventé ». Elle ne limite pas cette notion au fait d’être en mesure de divulguer comment réaliser l’invention.
[448] Cela ressort des observations de Gilead sous la rubrique « Nature de l’invention ». Celle‑ci s’appuie encore une fois sur l’arrêt Viagra, mais elle appuie l’argument portant que la Cour peut considérer des éléments de preuve extrinsèques pour établir la nature de l’invention. Cette observation devient cependant difficile à suivre selon moi lorsque l’on tient compte du fait que l’incapacité d’avoir fabriqué des composés 2’‑C‑Me/F malgré deux années d’efforts ne semble pas être en litige. L’inquiétude de Gilead est plutôt l’abandon par Idenix de la revendication 1. Gilead formule en ces termes son observation aux paragraphes 188 et 189 de ses observations écrites :
[traduction]
[188] Si l’on applique le raisonnement de l’arrêt Viagra, rien ne justifie que les composés visés par les revendications 1 à 3 soient traités comme des inventions distinctes. Il serait malhonnête de la part d’Idenix de prétendre qu’il n’y a qu’une seule invention pour échapper à l’action du bureau d’un examinateur, puis de faire valoir que chaque revendication se rapportait à une invention distincte pour les besoins de la présente action. Il s’agit d’une application directe du raisonnement tenu au paragraphe 68 de l’arrêt Viagra.
[189] Dans cet arrêt, la Cour suprême a examiné la conduite réelle des inventeurs pour établir la nature de leur invention. Dans la présente affaire, la conduite des inventeurs démontre clairement qu’ils ne disposaient pas d’une invention au moment du dépôt, étant donné qu’ils n’avaient aucun moyen de fabriquer les composés revendiqués. Par conséquent, le brevet 191 est invalide pour le motif fondamental que les inventeurs nommés n’avaient en réalité réalisé aucune invention, en contravention des principes de droit depuis longtemps énoncés par la Cour suprême du Canada dans l’arrêt de 1930 Christiani c Rice.
[Non souligné dans l’original.]
[449] L’observation de Gilead me pose problème, car je ne pense pas qu’Idenix soutient que les revendications 1 à 3 renvoient à des inventions distinctes. Cela semble être la conclusion de Gilead, étant donné qu’Idenix a ensuite choisi de ne pas défendre la revendication 1. Je dis cela parce que la référence, dans le paragraphe 189 susmentionné, au fait qu’Idenix n’avait aucun moyen de fabriquer les composés revendiqués semble se rapporter à son observation contenue au paragraphe 188. Cela paraît lié à son tour à la revendication 1 abandonnée et à l’incapacité d’Idenix à créer tous les composés dotés d’un groupe C(Y3)3 en position 2’ (haut). J’ai déjà renvoyé au paragraphe 80 de l’arrêt Viagra qui autorise l’abandon de revendications formulées en termes trop larges. Par conséquent, je rejette cette observation.
[450] Par ailleurs, si l’observation concerne l’incapacité d’Idenix de fabriquer les nucléosides 2’‑C‑Me/F en substituant un fluor en position 2’ bas, je conviens avec Idenix que cela n’entre pas en ligne de compte dans la définition de l’invention. En l’espèce, l’invention est le nucléoside 2’‑C‑Me/F dont l’utilité est prévisible. Je comprends que la question « Qu’est‑ce que l’invention » est une considération indépendante de l’obligation de décrire comment la réaliser. Dans un cas comme dans l’autre, il ne semble pas être obligatoire d’avoir été réellement en mesure de réaliser l’invention. Il n’y aurait autrement aucun fondement pour prédire l’utilité des inventions n’ayant pas été réalisées; ou à tout le moins, cela ajouterait un autre facteur à l’égard des inventions valablement prédites.
[451] Si la question connexe se rapportant aux inventions valablement prédites tient au fait que la prédiction de l’utilité est hypothétique sur la base des connaissances de l’inventeur, lorsque les connaissances véritables de ce dernier lui indiquent que le composé ne peut être fabriqué malgré des tentatives en ce sens, cette question n’a pas été plaidée ou à tout le moins débattue et je n’en suis pas saisi.
C. Le brevet 191 divulgue‑t‑il comment synthétiser le composé 2’‑C‑Me/F?
[452] Dans l’analyse qui suit, j’examine d’abord la question de savoir si, et dans quelle mesure, la synthèse du nucléoside 2’‑C‑Me/F est expressément divulguée dans le brevet 191, tout en gardant à l’esprit qu’il a été admis que le brevet ne décrit pas l’étape de fluoration, étape déterminante de la synthèse du nucléoside 2’‑C‑Me/F.
[453] Je me demanderai ensuite si les connaissances générales courantes et les essais courants suffisent à divulguer la synthèse des composés 2’‑C‑Me/F. Cette analyse repose sur le témoignage des experts et la preuve contemporaine des chimistes d’Idenix et de Gilead ayant pris part aux efforts de fabrication du composé durant la période pertinente allant de 2002 à 2004.
[454] En ce qui concerne l’analyse des travaux de M. Griffon, la Cour examinera également les allégations d’Idenix selon lesquelles il ne s’était pas conduit comme un chimiste versé dans l’art. Ainsi, il ne se serait pas rendu compte qu’il avait synthétisé le nucléoside 2’‑C‑Me/F, comme l’auraient démontré les expériences effectuées par AMRI pour le compte d’Idenix en 2014 dans une simulation de son expérience de février 2003 avec le Deoxo‑Fluor® sur un nucléoside glucidique.
1) La synthèse du composé 2’‑C‑Me/F est‑elle divulguée dans le brevet 191?
[455] La Cour examine ici la divulgation écrite explicite contenue dans le brevet 191 sans la divulgation additionnelle concernant la synthèse et issue des connaissances générales courantes
[456] Il est reconnu qu’aux dates pertinentes, la synthèse d’un nucléoside 2’‑C‑Me/F était nouvelle, comme l’a laissé entendre M. Barrett en déclarant qu’il n’avait jamais été fabriqué. Il est également reconnu que le brevet 191 ne contient aucune information sur l’étape de fluoration. Sur cette base uniquement, le brevet n’enseigne pas comment fabriquer les composés revendiqués. Il s’appuie sur les connaissances générales courantes et les expériences pour remplir les exigences en matière de divulgation relativement à l’étape essentielle de la fluoration.
[457] Le mieux qu’Idenix puisse donc faire est de démontrer que l’intermédiaire ayant servi à la synthèse du nucléoside 2’‑C‑Me/F – c’est un cycle glucidique ou un nucléoside 2’‑C‑OH/Me nécessaire à une fluoration par le DAST – a été divulgué dans le brevet 191. Aucune étape antérieure du procédé de synthèse n’est en litige. J’estime qu’Idenix n’enseigne pas comment fabriquer les composés intermédiaires dans le brevet 191. Pour l’essentiel, les quelques pages pertinentes de ce brevet sont consacrées à la synthèse des nucléosides 2’‑C‑Me/OH dont Idenix détenait les brevets, et non à l’intermédiaire à fluorer.
[458] Le brevet 191 revendique les nucléosides 2’‑C‑Me/F sans décrire aucun schéma de synthèse pour leur fabrication. Comme pour le précurseur, le cycle glucidique ou nucléoside 2’‑C‑OH/Me, les méthodes de synthèse du brevet 191 visent la classe des composés 2’‑C‑Me/OH comportant un substituant 2’‑OH (bas), et les instructions pour la fabrication des composés précurseurs 2’‑C‑OH/Me nécessaires à l’étape de la fluoration ne sont que déduites.
a) Les observations générales de Gilead sur la divulgation due à l’abandon par Idenix de revendications dans la demande
[459] Comme je l’ai mentionné, Idenix a abandonné un certain nombre de revendications et 22 de ses 23 formules dans la demande de brevet. Ces éléments ne figuraient pas dans le brevet 191 tel qu’il a été délivré. Les deux parties ont invité la Cour à se référer à l’historique du dossier du brevet 191 qui contient des éléments de preuve sur ces retranchements effectués par Idenix.
[460] Idenix a expliqué en ces termes l’effet de ces retranchements de sa demande de brevet :
[traduction]
[…] certains des termes employés dans le brevet 191 peuvent renvoyer à certaines des formules qui y sont divulguées, mais qui ne sont pas revendiquées dans le brevet tel qu’il a été délivré. Ainsi, certaines parties du mémoire descriptif qui visent des formules autres que la formule (IX) pourraient ne pas être pertinentes pour l’interprétation des revendications du brevet 191.
[461] Les témoins de Gilead, et en particulier M. Wnuk, ont formulé un avis sur les incohérences créées dans le brevet 191 du fait du retrait des revendications et des formules, ainsi que de la revendication restante en cause. À titre d’exemple, je reproduis un résumé de son avis à cet égard provenant de son premier rapport :
[traduction]
b) À mon avis, la personne versée dans l’art aurait compris par le titre du brevet 191 et les premières pages du mémoire descriptif que le brevet vise les promédicaments 2’ et 3’ de nucléosides ramifiés en position 1’, 2’, 3’ ou 4’ pour le traitement des infections à Flaviviridae telles que les infections par le VHC. Le brevet 191 décrit 23 formules qui englobent chacune une grande classe différente de nucléosides substitués. La personne versée dans l’art aurait compris que les substituants disponibles à chacune des positions du cycle glucidique variaient selon la formule, y compris les modifications au cycle glucidique même. Elle aurait aussi compris que les formules du brevet 191 comportent un grand nombre de bases non naturelles. Dans l’ensemble, elle aurait compris que ce brevet vise une énorme quantité de nucléosides ayant divers substituants possibles sur le cycle glucidique ainsi que sur la base. Elle saurait que le brevet 191 présente des méthodes de synthèse et des exemples de fabrication de certains nucléosides figurant dans le mémoire descriptif ou le corps de ce brevet (lequel, si je comprends bien, est la partie du brevet qui précède les revendications), mais sûrement pas de l’ensemble des nucléosides. En particulier, la personne versée dans l’art saurait que le brevet 191 ne présente ni méthode ni exemples décrivant comment fabriquer les nucléosides avec un substituant autre que l’OH ou le H en position 2’ (bas) ou 3’ (bas). Elle aurait également compris que le brevet 191 donne des exemples de préparation de produits de départ et d’intermédiaires pouvant servir à la synthèse de nucléosides particuliers avec substitution en position 4’. Le brevet renseigne en outre sur certains essais biologiques qui, selon ce que le brevet renferme, peuvent servir à l’évaluation des composés qu’il mentionne, ainsi que sur les résultats des essais biologiques d’un composé unique qu’il nomme le composé F. La personne versée dans l’art aurait remarqué que le brevet 191 ne présente ni structure chimique ni dessin pour décrire le composé F. Elle aurait enfin constaté que la nomenclature offerte pour ce même composé est incomplète et ne lui permet donc pas d’en comprendre la structure exacte.
c) La personne versée dans l’art aurait compris que le brevet 191 se termine par 32 revendications. Les revendications 1 à 3 se rapportent à des structures chimiques particulières. Les revendications 4 à 32 traitent de l’utilisation des composés des revendications 1 à 3 pour le traitement des infections à Flaviviridae, y compris le VHC. Au lieu de viser des promédicaments modifiés en position 2’ et 3’ de nucléosides ramifiés en position 1’, 2’, 3’ ou 4’ ou les 23 formules contenues dans le mémoire descriptif, les revendications 1 à 3 concernent une seule formule, la formule (IX). Par ailleurs, tout en demeurant très larges, les revendications 2 et 3 limitent les nucléosides visés à ceux qui comportent un méthyle (haut) et un fluor (bas) en position 2’. La personne versée dans l’art aurait jugé inattendu l’accent mis sur ce profil de substitution en particulier, étant donné que le brevet 191 ne souligne ni ne présente d’exemple ou de schéma concernant un nucléoside portant ces deux substituants. Elle aurait en outre été confondue par la portée des revendications, l’accent étant nettement mis dans les exemples sur les nucléosides porteurs d’un groupe méthyle en position 4’ et aucun nucléoside du genre ne semblant visé par les revendications.
[462] Les commentaires de M. Wnuk sur le contenu du brevet 191 pris sans l’interprétation d’un chimiste versé dans l’art cherchant à comprendre le brevet sont irréfutables. Certains ont été confirmés par M. Damha lors de son contre‑interrogatoire. Cependant, ces commentaires ne portaient pas sur la partie du mémoire descriptif consacrée aux revendications ni sur l’avis de M. Damha quant à l’étendue des directives erronées.
[463] Dans le rapport qu’il a soumis en réplique à l’interprétation par M. Wnuk du brevet 191, tel qu’il se lisait sans le secours des informations provenant du dossier de demande, M. Damha a fourni une explication similaire à celle contenue dans les observations qu’Idenix a présentées à la Cour :
[traduction]
Cependant, M. Wnuk n’a pas mentionné qu’au cours de l’instruction de la demande de brevet 191, l’Office de la propriété intellectuelle du Canada a pris une action administrative exigeant que le brevet 191 se limite à une seule invention. À ce titre, les revendications de ce brevet ont été limitées aux composés de formule (IX) et à leur utilisation. Les commentaires de M. Wnuk sur des aspects de la divulgation de composés dont la formule est différente de la formule (IX) sont donc déplacés.
[464] La véritable interprétation du brevet 191 doit être dégagée en tenant compte de ce qu’une personne versée dans l’art prenant connaissance du mémoire descriptif à la date de sa délivrance aurait estimé qu’il divulguait et revendiquait (Free World, au paragraphe 52). À ce titre, le brevet 191 doit être interprété sans s’appuyer sur des éléments de preuve extrinsèques, lesquels incluent d’après moi les informations contenues dans les dossiers de l’OPIC.
[465] Cependant, j’estime aussi que le chimiste versé dans l’art aurait conclu à un manque de cohérence entre les revendications et une grande partie du mémoire descriptif. Cela l’aurait amené à reconnaître la seule formule pertinente basée sur la formule (IX) avec le fluor en position 2’ (bas). À cet égard, je conviens donc avec M. Damha que l’interprétation retenue par M. Wnuk du mémoire descriptif du brevet est trop littérale. Mais si elle rend compte d’une première impression du document, cette interprétation ne précise pas ce qu’une personne versée dans l’art aurait fini par en dégager.
[466] D’autre part, une grande partie des 170 pages nous en apprend très peu, et il arrive souvent que le mémoire descriptif donne des directives erronées. Cela se produit dans les schémas et les discussions sur la synthèse que l’on a considérés comme pertinents uniquement pour la divulgation de la façon de fabriquer les nucléosides 2’‑C‑Me/OH, et non le diastéréomère 2’‑C‑OH/Me utilisé comme intermédiaire dans la synthèse des nucléosides 2’‑C‑Me/F.
[467] Par ailleurs, je conclus que rien n’empêchait la Cour d’interpréter les revendications, qui visaient clairement toutes des composés portant un méthyle (haut) et un fluor (bas) en position 2’ du cycle glucidique. La revendication 1, qui a été abandonnée par Idenix, visait de même les autres composés revendiqués porteurs du fluor en position 2’ (bas).
[468] Les témoins experts d’Idenix ont aidé la Cour à interpréter les revendications, et l’ont aussi renvoyée aux parties du brevet 191 qu’ils estimaient pertinentes au regard des questions à trancher, comme la section des définitions des bases. Gilead a attiré l’attention de la Cour sur les incohérences du mémoire descriptif qui nuisaient à l’interprétation des revendications, par exemple les références variées et différentes aux phosphates. Gilead n’a fait valoir aucun argument général voulant que les revendications soient inintelligibles sur ces questions en raison du contenu du mémoire descriptif.
[469] Cependant, j’attribue un certain poids à l’avis de M. Wnuk selon lequel la divulgation de la synthèse du nucléoside 2’‑C‑Me/F était compromise par le fait qu’une grande partie du mémoire descriptif était dépourvu de pertinence, ce qui rendait encore plus difficile la détermination de l’information pertinente. Cela s’ajoute au fait que le brevet 191 ne renseignait en rien sur l’étape essentielle de la fluoration pour la fabrication de l’invention et que les schémas du brevet dirigeaient la personne versée dans l’art vers le 2’‑C‑Me/OH comme produit final, c’est‑à‑dire loin de son composé diastéréomère 2’‑C‑OH/Me en tant qu’intermédiaire approprié pour la synthèse du nucléoside 2’‑C‑Me/F, ce qui me conforte dans ma conclusion selon laquelle il manquait aussi une divulgation expresse de la synthèse de l’intermédiaire.
b) Les schémas de synthèse du composé intermédiaire 2’‑C‑OH/Me
[470] On savait qu’il existait trois approches pour effectuer la synthèse du nucléoside 2’‑C‑Me/F et que, dans deux d’entre elles, les composés 2’‑C‑OH/Me servaient d’intermédiaires. Les schémas 11 et 5 du premier rapport de M. Barrett présentés ci‑après décrivent les deux premières approches : la modification d’un nucléoside et la N‑glycosidation (cycle glucidique). Dans la première approche, on utilise un nucléoside de départ et, dans la deuxième, on modifie un produit de départ dérivé d’un cycle glucidique D‑ribose qui, après fluoration du cycle, est couplé à une base uracile par glycosidation. Aux fins de l’examen de la divulgation de la synthèse de l’intermédiaire, seule l’étape de méthylation (p. ex., l’étape entre les molécules 64 et 65 du schéma 11 ci‑après où l’on ajoute le groupe CH3) qui crée les précurseurs 2’‑C‑OH/Me est en litige.
(i) L’approche de la modification d’un nucléoside
[471] Les dessins du schéma 11 de M. Barrett débutent par le composé nucléosidique d’uracile 62 qui est protégé aux groupes 3’‑ et 5’‑hydroxyl du sucre pour donner le composé 63. Celui‑ci est oxydé à l’aide d’un réactif qui transforme le 2’-alcool (CH3) en 2’‑cétone (O), ce qui donne le nucléoside 64. Ces deux étapes sont décrites dans le brevet 191 et ne sont pas en litige.
[472] Le nucléoside 64 est méthylé à l’aide de méthyllithium dans de l’oxyde de diéthyle à ‑78 oC suivant la méthode de A. Matsuda et al., ce qui crée le nucléoside 65, qui est le nucléoside 2’‑C‑OH/Me. C’est là le nucléoside intermédiaire recherché qui, une fois fluoré, deviendra le nucléoside 2’‑C‑Me/F. Cette étape de méthylation (entre les nucléosides 64 et 65) est à comparer aux schémas présents dans le brevet 191 (voir plus loin le schéma 3 sous le titre « Synthèse des nucléosides ramifiés en 2’‑C), qui ne montrent ni ne mentionnent l’intermédiaire, ne présentant que le composé nucléosidique 2’‑C‑Me/OH d’Idenix.
[473] Dans les dessins de M. Barrett, après des étapes de déprotection et de protection, le nucléoside 65 est fluoré au moyen du DAST dans une solution de toluène à ‑20 oF, ce qui donne le produit cible protégé, le nucléoside 2’‑C‑Me/F 66, ainsi que des produits d’élimination non présentés dans le schéma. Le brevet 191 ne renseigne pas sur cette étape. Le composé 66 est déprotégé, et on aboutit au composé 61, le nucléoside 2’‑C‑Me/F cible. Toute l’étape de fluoration est absente du brevet 191.
(ii) L’approche de la N‑glycosidation
[474] L’approche de la N‑glycosidation, ou approche du cycle glucidique, est en grande partie semblable à celle du nucléoside, sauf que le produit de départ est un cycle glucidique D‑ribose et que le réactif DAST n’est pas dans une solution de toluène. Après l’étape de fluoration, une réaction de Vorbrüggen suivie d’une étape de déprotection est employée pour parachever la synthèse et ajouter la base. L’approche est décrite au schéma 5 ci‑après, qui est tiré du rapport de M. Barrett.
(iii) L’approche de la gemcitabine
[475] L’approche de la gemcitabine, ou « stratégie de la petite molécule », est ainsi nommée parce qu’elle a servi à l’origine à produire le médicament anticancéreux portant ce nom. Dans la procédure décrite dans le schéma 25 ci‑après, on utilise une réaction aldolique ou de Reformatsky, suivie d’une cyclisation, pour former un sucre dans lequel les substituants « 2’‑méthyl (haut) »-2’‑F (bas) occupent déjà leurs positions correctes auxquelles une base est couplée. Il n’y a ni mention ni description de schéma dans le brevet 191.
(iv) Les schémas du brevet 191
[476] Les schémas pertinents du brevet 191 présentent tous le composé cible avec l’hydroxyle demeurant en position 2’ (bas), c’est‑à‑dire les nucléosides 2’‑C‑Me/OH brevetés par Idenix. Autrement dit, ces schémas ne décrivent pas le diastéréomère inversé intermédiaire 2’‑C‑OH/Me ni les composés cibles 2’‑C‑Me/F. Le schéma 3 du brevet, typique de ces schémas, décrit une approche de N‑glycosidation qui débute par un cycle glucidique, avec un nucléoside 2’‑C‑Me/OH comme produit précédant les étapes facultatives de protection et de réduction. Il figure à la page 123 du brevet à la section « B. General Synthesis of 2 ‘‑C‑Branched Nucleosides”, 1. Glycosylation of the nucleobase with an appropriately modified sugar. Le schéma se lit de gauche à droite en haut, puis vers le bas.
[477] Le premier composé est le produit de départ, c’est‑à‑dire le cycle glucidique D‑ribose. Le deuxième composé est le résultat de l’oxydation du produit de départ et le troisième composé, celui de la méthylation, c’est‑à‑dire le composé à cycle glucidique 2’‑C‑Me/OH (le méthyle est le substituant R6) avant couplage avec la base. Le quatrième composé à la ligne de dessous présente le couplage de la base au cycle glucidique, ce qui donne le nucléoside 2’‑C‑Me/OH cible. Les cinquième et sixième composés, qui représentent l’étape de protection et l’étape facultative de réduction, ne sont pas pertinents.
[478] Le schéma 4 à la page 125 du brevet 191 décrit l’approche de modification d’un nucléoside, laquelle est similaire à celle du schéma 3, sauf que le produit de départ est un nucléoside. Le schéma 9, version plus générale, présente également le composé cible avec l’OH en position 2’ (bas) et une base purique. Le nucléoside 2’‑C‑Me/F n’est actif qu’avec les bases pyrimidiques uracile et cytidine. Les dessins décrivent tous la synthèse du nucléoside 2’‑C‑Me/OH, alors que le schéma 9 comporte une base qui ne conférerait aucune activité antivirale si le diastéréomère du 2’‑C‑Me/OH (le composé 2’‑C‑OH/Me) était utilisé pour fabriquer un nucléoside 2’‑C‑Me/F.
c) La preuve des experts d’Idenix sur la divulgation du brevet 191
[479] Malgré les schémas qui dirigent la personne versée dans l’art vers la synthèse du nucléoside 2’‑C‑Me/OH, les experts d’Idenix insistent pour dire que le brevet 191 enseigne comment fabriquer les composés intermédiaires 2’‑C‑OH/Me. M. Barrett résume en ces termes les arguments d’Idenix au paragraphe 128 de son rapport de novembre :
[traduction]
[128] Dans ce cas, le brevet 191 décrit explicitement deux méthodes possibles de synthèse de molécules précurseurs appropriées. Une seule autre étape s’ajoute à ce qui est décrit dans le brevet 191 et cette étape, à savoir la substitution d’un alcool pour fournir un fluorure, aurait été simple pour la personne versée dans l’art, surtout qu’elle était amplement décrite dans les antériorités contemporaines.
[Non souligné dans l’original.]
[480] Lorsqu’il explique la description explicite de la façon d’appliquer les deux méthodes possibles, M. Barrett commence par l’analyse rétrosynthétique que ferait la personne versée dans l’art en partant des propriétés chimiques du composé 2’‑C‑Me/F. Après avoir considéré le composé cible, la personne versée dans l’art serait amenée à conclure que, pour synthétiser le composé, il faut employer la méthode de fluoration par le DAST. Cette recherche amènerait aussi le chimiste versé dans l’art à reconnaître que la molécule intermédiaire visée doit présenter un méthyle (bas) et un hydroxyle (haut), c’est‑à‑dire inversés, en position 2’ par rapport à tous les composés décrits dans les schémas du brevet 191.
[481] En toute déférence, j’estime qu’une analyse rétrosynthétique pour la fabrication d’un composé qui n’est ni décrit ni présenté dans le brevet n’est pas ce que la personne versée dans l’art considérerait comme une description explicite de la méthode de fabrication de ce composé.
[482] À partir de ce point de départ non décrit d’une analyse rétrosynthétique comme première étape essentielle d’une nouvelle synthèse, le chimiste versé dans l’art serait dirigé vers le composé intermédiaire par l’article d’O’kuru. Il revient au chimiste versé dans l’art de le retrouver parmi les quelques passages pertinents du brevet 191. M. Barrett déclare ce qui suit :
[traduction]
À tout le moins, Harry‑O’kuru et l’exemple 2 enseignent à la personne versée dans l’art comment utiliser tous les réactifs nécessaires et effectuer toutes les réactions requises pour la synthèse du nucléoside 41, sauf pour ce qui est de l’étape de conversion de l’alcool en fluorure.
[483] À mon avis, il vaudrait mieux dire que, « tout au plus », la personne versée dans l’art pourrait trouver son chemin vers la synthèse de l’intermédiaire du brevet 191, sauf que je souscris à l’argument de Gilead selon lequel le passage en question où est cité l’article d’O’kuru dirige tout autant la personne versée dans l’art loin de l’intermédiaire 2’‑C‑OH/Me :
[traduction]
EXEMPLE 2 : RÉPARATION DE LA 2’‑C‑MÉTHYLRIBO‑8‑MÉTHYLADÉNINE
Le composé en objet a été préparé conformément à la méthode publiée (R.E. Harry O’kuru, J.M. Smith, and M.S. Wolfe, « A short, flexible route toward 2’‑C‑branched ribonucleosides », J. Org. Chem. 1997, 62 1754‑1759) (schéma 9).
[Non souligné dans l’original.]
[484] L’exemple 2 renvoie explicitement au schéma 9, qui représente le composé 2’‑C‑Me/OH, là aussi avec une base purique plutôt que pyrimidique. Le composé visé dans le schéma 9 est aussi le 2’‑C‑Me/OH, et non l’intermédiaire 2’‑C‑OH/Me.
[485] Comme l’a en outre fait remarquer Gilead, l’article d’O’kuru n’explique ni ne mentionne explicitement l’étape de méthylation par le méthyllithium dans le diéthyle pour créer le composé intermédiaire 2’‑C‑OH/Me. Il renvoie plutôt à l’article de Matsuda utilisé par Jeremy Clark, A. Matsuda et al., « Alkyl Addition Reaction of Pyrimidine 2’‑Ketonucleosides: Synthesis of 2’‑Branched‑Chain Sugar Pyrimidine Nucleosides », Chemical Pharamaceutical Bulletin, 1988, 36(3), 945‑953. L’article de Matsuda expose la méthode pour synthétiser le composé précurseur 2’‑C‑OH/Me. L’article d’O’kuru ne mentionne l’article de Matsuda que dans une note de bas de page. Le passage qui renvoie à la note de bas de page ne porte pas sur les antiviraux, mais sur les composés anticancéreux. Il dit ce qui suit :
[traduction]
Ces 10 dernières années, un certain nombre de nucléosides ramifiés en 2’‑C se sont révélés prometteurs contre le cancer (note de bas de page 1) […]
[486] La note de bas de page no 1 contient une longue liste d’articles de référence, dont la quasi‑totalité est écrite par M. Matsuda ou a bénéficié de sa contribution, et aucun d’entre eux ne porte de titre :
[487] Le document de Matsuda, qui est l’article 1 (b) dans la note de bas de page, est tout aussi imprécis, en ce sens que le type de réaction doit d’abord être choisi parmi les divers exemples cités. Si l’on choisit celui qui assure une stéréosélectivité, on est conduit à 10 exemples différents tirés d’expériences, parmi lesquels l’exemple 6 est le bon :
[488] Je conviens avec Gilead que ce n’est pas là une divulgation expresse de la façon de fabriquer les composés intermédiaires nécessaires à la synthèse du nucléoside 2’‑C‑Me/F.
[489] Idenix fait en outre valoir que ce qui est dit en matière de stéréochimie aux pages 102 et 103 du brevet est suffisant pour divulguer la façon de synthétiser le précurseur 2’‑C‑Me/OH. Elle fait ici référence aux propriétés utiles des nucléosides dans le processus de méthylation utilisé pour former le nucléoside 2’‑C‑Me/OH. Elle fait valoir que [traduction] « [c’]est suffisant pour divulguer la façon de synthétiser le précurseur 2’‑C‑Me/OH ».
[490] À cet égard, M. Wnuk a reconnu qu’il relevait des connaissances générales courantes que l’application d’une forme du réactif bien connu de Grignard dont parle le brevet créerait un mélange racémique de diastéréomères des composés 2’‑C‑Me/OH et 2’‑C‑OH/Me qui pouvait être séparé afin d’obtenir l’énantiomère précurseur désiré.
[491] Toutefois, on ne peut pas dire de la mention générale d’une forme de réactif donnant comme sous‑produit un composé 2’‑C‑Me/OH sans aucun lien avec les enseignements relatifs à la fabrication de ce composé qu’elle divulgue suffisamment comment fabriquer le composé intermédiaire. En effet, je conclus qu’Idenix s’appuie sur les connaissances générales courantes pour dire au lecteur versé dans l’art que le composé 2’‑C‑OH/Me est l’intermédiaire nécessaire à la fabrication des nucléosides 2’‑C‑Me/F et que cet intermédiaire se fabrique d’une telle façon, en se contentant au mieux de donner des bribes d’information utile bien enfouie dans le brevet 191.
d) La comparaison avec la description du brevet 657
[492] Le brevet 191 peut se comparer au brevet 657, lequel renferme six schémas contenant tous les détails au sujet des étapes de la synthèse du nucléoside 2’‑C‑Me/F et les particularités de chaque étape. En voici un exemple relativement à l’approche du cycle glucidique. Le schéma débute après l’étape d’oxydation déjà décrite où une cétone a été appliquée à un cycle glucidique protégé pour produire le composé 3‑1. L’étape 1 est celle de la méthylation qui produit le cycle glucidique 2’‑C‑OH/Me. L’étape 2 est l’étape de fluoration qui produit le cycle glucidique 2’‑C‑Me/F. Les étapes 3, 4 et 5 sont les étapes de glycosidation qui produisent le nucléoside à base uracile comme composé 3‑6.
[traduction]
Exemple 1 : Synthèse de la (2’R)‑2’‑désoxy‑2‑fluoro‑2’‑C‑méthylcytidine à partir d’un glucide [cycle glucidique sans la base]
Étape 1 : Le composé 3‑1 (7,7 g, 0,022 mmol) a été dissous dans de l’oxyde de diéthyle anhydre et refroidi à ‑78 oC. À cette solution a été ajouté du MeLi (30 mL, 1,6 M dans l’oxyde de diéthyle). Une fois la réaction complète, le mélange a été traité au chlorure d’ammonium (l M, 65 mL) et la phase organique a été séparée, séchée (Na2S04), filtrée et concentrée jusqu’à dessiccation. Une chromatographie sur gel de silice, suivie d’une cristallisation à partir de l’oxyde de diéthyle‑hexanes a donné le composé 3‑2 pur (6,31 g). RMN 1H (400 MHz, CDC13) : δ 1,40 (s, 3H), 3,41 (s, 3H), 3,49 (dd, 1H, J = 10,3, 6,89 Hz), 3,57 (dd, 1H, J = 10,3, 3,88 Hz). 3,84 (d, 1H, J = 7,3 Hz), 4,03 (m, 1H), 4,48 (s, lH), 4,58 (m, 3H), 4,83 (d, 1H, J = 11,6 Hz), 7,31‑7,36 (m, 10H); RMN 13C (100 MHz, CDCl3) : δ 18,4, 55,4, 72,2, 73,4, 79,5, 80,2, 84,7, 107,4, 127,7, 127,8, 127,83, 128,5, 138,2, 138,3.
Étape 2 : Le composé 3‑2 a été dissous dans du CH2C2 et traité au DAST (4,0 mL, 30,3 mmol) à la température ambiante. La solution a été agitée toute la nuit à la température ambiante. Le mélange ainsi obtenu a été versé dans du NaHC03 saturé (100 mL) et lavé avec du NaHC03 saturé (l x 15 mL). La couche organique a été traitée de la manière habituelle. La chromatographie sur gel de silice (1:5 EtOAc‑hexanes) a donné le composé 3‑3 brut (0,671 g) qui était suffisamment pur pour l’étape suivante. RMN 1H (400 MHz, CDCl3) : δ 1,43 (d, 3H, J = 22,8 Hz), 3,35 (s, 3H), 3,49 (dd, 1H, J = 10,5, 5,4 Hz), 3,55 (dd, 1H, J = 10,5, 4,1 Hz), 3,87 (dd, 1H, J = 23,5, 7,5 Hz), 4,26 (m, 1H), 4,56 (d, 2H, J = 6,9 Hz), 4,66 (d, 2H, J = 8,2 Hz), 4,72 (d, 1H, J = 10,8 Hz), 7,29‑7,36 (m, 10H); .13 C RMN (100 MHz, CDCl3) : δ 17,0 (d, J = 24,4 Hz), 55,2, 77,1, 73,4, 73,8, 77,3, 80,3, 81,2 (d, J = 16 Hz), 99,7 (d, J = 178,9 Hz), 106,8 (d, J = 32,0 Hz), 127,7, 127,8, 128,1, 128,3, 128,5, 128,6, 137,8, 138,3; RMN 19F (100 MHz, CDC13) : δ 8,2 (m, IF).
Étape 3 : Le composé 3‑3 (0,39 g, 1,1 mmol) a été dissous dans du 1:2 EtOH‑EtOAc et traité au Pd/C (~0,l g) et au cyclohexène (~1 mL). Le mélange a été chauffé à reflux toute la nuit, puis filtré à la célite*. Le solvant a été retiré sous vide et le résidu a été dissous dans de la pyridine (~5 mL). À cette solution a été ajouté du chlorure de benzoyle (0,22 mL, 1,83 mmol), et le mélange a été agité toute la nuit à la température ambiante. La pyridine a été retirée sous vide et le résidu a été partagé entre le CH2Cl2 et le NaHCO3 saturé (10,0 mL). La phase organique a été séchée (Na2SO4) et filtrée, et la solution a été concentrée jusqu’à dessiccation. La chromatographie sur colonne a donné 0,350 g du composé 3‑4 pur. RMN 1H (400 MHz, CDCl3) : δ 1,53 (d, 3H, J = 22,4 Hz), 3,39 (s, 3H), 4,46 (dd, JH, J = 11,6, 4,7 Hz), 4,58 (m, lH), 4,65 (dd, lH, J = 11,6, 3,9 Hz), 4,87 (d, 1H, J = 9,9 Hz), 5,64 (dd, 2H, J = 24,1, 7,8 Hz), 7,29‑7,36 (m, 10H); RMN 19F (l00 MHz, CDCl) : δ 7,5 (m, IF).
Étape 4 : Une solution de bis(triméthylsilyl)‑N‑benzoylcytosine (0,28 g, 0,77 mmol) et du composé 3‑4 (0,20 g, 0,5 mmol) dans du 1,2 dichloréthane (2 mL) et du toluène (2 mL) a été traitée au TMSOTf (0,15 mL, 0,77 mmol). Après disparition de la plus grande partie du produit de départ, d’après la chromatographie sur couche mince, la solution a été refroidie à la température ambiante, lavée à l’eau (1 x 5 mL), saumurée (1 x 5 mL), séchée (Na2S04), filtrée et concentrée jusqu’à dessiccation. Une chromatographie rapide suivie d’une cristallisation à partir du CH2Cl2‑hexanes a donné le composé 3‑5 (68 mg). pf 241 oC; RMN 1H (400 MHz, CDCl3) : δ 1,49 (d, 3H, J = 22,4 Hz), 4,64 (dd, 1H, J = 12,9, 3,4 Hz), 4,73 (app d, 1H, J = 9,5 Hz), 4,89 (dd, 1H, J = 12,7, 2,2 Hz), 5,56 (dd, 1H, J = 20,7, 8,6 Hz), 6,52 (d, 1H, J = 15,9 Hz), 7,38‑7,67 (m, 10H), 7,89 (d, 2H, J = 6,9 Hz), 8,07‑8,11(m, 5H), 8,67 (s, 1H); RMN 19F (100 MHz, CDCl3) : δ 2,85 (m, IF).
Étape 5 : Le composé 3‑5 (40 mg, 0,05 mmol) a été dissous dans de l’ammoniaque méthanolique et agité pendant 48 heures à la température ambiante. La solution a été concentrée jusqu’à dessiccation, soumise à une chromatographie (SiO2) et éluée avec du 1:4 EtOH‑CH2Cl2. Le rendement a été d’environ 12 mg de (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine pur, le composé 3‑6. RMN 1H (400 MHz, DMSO‑d6) : δ 1,16 (d, 3H, J = 22,0 Hz), 3,61 (dd, 1H, J = 11,6, 5,2 Hz), 3,60‑3,83 (m, 3H, J = 10,5, 5,4 Hz), 5,24 (S, 1H, échangeable avec du D2O), 5,59 (s, 1H, échangeable avec du D2O), 5,71 (d, lH, J = 7,3 Hz), 6,08 (d, 1H, J = 19,0 Hz), 7,24 (d, 1H, J = 17,7 Hz, échangeable avec du D2O), 7,87 (Cd, lH); RMN 19F (100 MHz, DMSO‑d6) : δ 4,13 (m, IF).
[493] Compte tenu des détails fournis dans le brevet 657, reconnus par M. Damha, je trouve incompréhensible qu’il ait pu déclarer pendant son témoignage que le brevet 191 fournissait le même degré de spécificité de synthèse. Je reproduis ici sa déposition tirée du passage reproduit ci‑après aux pages 2517 et 2518 de la transcription :
[traduction]
Et convenez‑vous avec moi que, aux pages 70 à 88, l’inventeur de Pharmasset, M. Clark, présente un protocole très précis de synthèse de nucléosides 2’-méthyl‑fluoro par l’approche du nucléoside et par l’approche du cycle glucidique?
R. Oui.
Q. Et il précise les réactifs, les concentrations, les températures et toutes les conditions de réaction dont aurait besoin le lecteur de ce brevet pour fabriquer ces composés, n’est‑ce pas?
R. Oui, il fournit des détails expérimentaux à cette fin.
Q. Et on ne retrouve pas ce même niveau d’information dans le brevet 191; le reconnaîtrez‑vous?
R. Je ne suis pas d’accord.
[…]
LE TÉMOIN : D’accord. Avec l’exception, monsieur le juge, de la réaction au DAST, tout le reste se trouve dans le brevet 191, l’oxydation –
e) Conclusion relative à la divulgation de la synthèse des nucléosides 2’‑C‑Me/F dans le brevet 191
[494] Les experts d’Idenix insistent pour dire que les schémas inclus dans la description du brevet 191 concernent les précurseurs des composés revendiqués. Je souscris à l’observation de Gilead selon laquelle un examen de ces schémas, ainsi que d’autres brevets déposés par Idenix, démontre que cet argument n’est rien de plus qu’une tentative de sa part, avec le recul, de voir dans le brevet 191 une chose qui ne s’y trouve tout simplement pas.
[495] De plus, ces mêmes schémas et des instructions identiques de fabrication des composés dans le brevet 191 figurent aussi dans des brevets antérieurs d’Idenix qui ne revendiquent aucun composé fluoré (la demande de brevet 351, ayant précédé le brevet 191).
[496] Ce qui est plus important encore, c’est qu’il est incontestable qu’aucun schéma ou exemple de synthèse du brevet 191 n’offre d’instructions sur la fluoration des nucléosides ou des cycles glucidiques. Je me range à l’opinion indiscutable de M. Wnuk selon laquelle le brevet 191 n’évoque même pas de produits de départ, de réactifs ou de conditions de réaction qui pourraient être utilisés pour la fabrication de tels composés et qu’il ne fait aucune mention que ce soit de la fluoration ni des réactions de fluoration.
[497] À mon avis, l’absence de divulgation utile dans le brevet 191, qui donne des directives erronées au lecteur et le plonge dans la confusion, comme l’a décrit M. Wnuk, place en général la personne versée dans l’art dans la même situation que celle où se trouvait M. Griffon, M. Jeremy Clark, M. Stewart et Mme Yang au début de leurs projets de recherche visant à fabriquer le composé. Ils n’auraient aucune indication, sauf la formule du composé elle‑même et certaines des étapes initiales et terminales généralement bien connues (protection, oxydation, couplage, etc.), sans précision aucune sur l’approche de la gemcitabine.
[498] Le chimiste versé dans l’art commençait essentiellement avec une feuille blanche et se tournait vers les moteurs de recherche avec devant lui le dur travail nécessaire pour fabriquer le nouveau composé 2’‑C‑Me/F sans même être au fait de toutes les tentatives infructueuses d’Idenix au moment de la demande de brevet 657.
[499] La preuve suivante émanant des experts d’Idenix étaye cette conclusion. Ceux‑ci s’appuient sur une analyse rétrosynthétique pour synthétiser le composé cible. Une description qui est censée commencer à la fin du procédé avec le composé synthétisé est un indice que le lecteur versé dans l’art doit lui‑même découvrir les étapes importantes de la synthèse sans guère être aidé en la matière par le brevet 191.
[500] Je conclus que le brevet 191 ne divulgue la synthèse ni du composé 2’‑C‑Me/F ni de ses composés précurseurs 2’‑C‑OH/Me.
D. La synthèse du composé 2’‑C‑Me/F relève‑t‑elle de l’application de connaissances générales courantes et d’essais courants?
1) Analyse rétrosynthétique
[501] Il est généralement admis que la demande de brevet WO 2005/003147 de Pharmasset, qui a été publiée le 13 janvier 2005 (la publication WO de Clark), était la première à divulguer la façon de fabriquer tout composé 2’‑C‑Me/F. Quiconque aurait tenté de fabriquer ce nucléoside auparavant aurait eu à travailler à rebours à partir de la formule sans aucun document publié pour lui dire comment faire.
[502] Les experts conviennent également que la synthèse du nucléoside 2’‑C‑Me/F exigeait une forme d’analyse « rétrosynthétique », c’est‑à‑dire d’une analyse dans laquelle on rétrograde en partant de la formule et de la structure. Après que la Cour se fut interrogée à un certain moment sur la possibilité d’employer une analyse rétrosynthétique comme divulgation habilitante, cette forme d’analyse a disparu dans la description par Idenix du procédé de synthèse que suivrait le chimiste versé dans l’art. Ainsi, M. Barrett est quelque peu revenu de son affirmation quant au besoin de recourir à une forme d’analyse rétrosynthétique, laissant entendre que la route à suivre était clairement indiquée à la personne versée dans l’art simplement par l’examen du composé même, ce qui est pour moi la même chose. Néanmoins, dans l’analyse figurant dans son rapport de novembre, il mentionne les étapes d’une analyse rétrosynthétique (paragraphes 132, 135, 162, 164 et 181).
[503] M. Damha a livré à la Cour la description la plus complète de ce qu’impliquait une analyse rétrosynthétique au paragraphe 113 de son rapport du 7 septembre 2014. J’ai numéroté les points saillants entre crochets :
[traduction]
[113] […] Dans les termes les plus généraux, la personne versée dans l’art regardera le composé cible à synthétiser. Elle procédera à une analyse rétrosynthétique ou à une analyse rétrosynthétique partielle [1] en rétrogradant du composé cible vers un composé connu. Dans le cas de certains composés cibles, une analyse rétrosynthétique complète, dans laquelle tous les précurseurs possibles sont examinés, [2] ne sera peut-être pas nécessaire si la voie de synthèse adéquate est plus probable que toute autre voie. Tel est le cas avec le composé revendiqué, qui exige réellement une synthèse simple. À partir de cette analyse rétrosynthétique, un schéma de synthèse est établi, lequel [3] requerra souvent des étapes multiples avec des composés intermédiaires, y compris l’utilisation de groupes protecteurs pour empêcher que les composés intermédiaires ne subissent des réactions non voulues. Une recherche documentaire est effectuée pour vérifier les conditions de réaction [4] aux diverses étapes du schéma de synthèse. [5] On procède ensuite aux expériences pour synthétiser le composé cible. On peut employer des techniques de purification et d’analyse [6] des composés intermédiaires et [7] du composé cible. Cette approche courante est la pratique commune et reconnue pour la personne versée dans l’art non seulement au début des années 2000, mais dans toute l’histoire de la chimie.
[504] La Cour n’a reçu aucune documentation démontrant qu’une analyse rétrosynthétique pouvait être utilisée pour enseigner comment fabriquer un composé fait de cette manière. On s’en étonnera, puisqu’il s’agit nettement d’un outil courant du domaine. Selon M. Stuyver, l’analyse rétrosynthétique est un processus de découverte de nouveaux composés, et non pas un moyen d’enseigner comment fabriquer un composé déjà inventé. Voici la définition qu’a donnée M. Patterson de l’analyse rétrosynthétique :
[traduction]
Vous partez avec l’idée de votre molécule cible à l’esprit et vous travaillez à rebours, d’étape en étape, jusqu’à ce que vous arriviez à un certain composé de départ couramment disponible et offert sur le marché, faut‑il espérer.
[505] Un plan rétrosynthétique est au mieux une carte routière conditionnelle servant à trouver une voie dans un labyrinthe de recherches et d’essais successifs et où, si l’on se retrouve dans une impasse, on revient au dernier pas, et peut‑être au pas précédent, et l’on essaie une autre voie. Il n’y a pas de connaissances générales courantes en matière de plans, puisqu’ils sont tous différents et qu’ils dépendent du contexte, notamment des capacités de la personne qui les conçoit et qui, dans le cas d’un chimiste versé dans l’art, n’a pas une grande expérience dans le domaine. L’analyse rétrosynthétique acquiert précisément son utilité dans l’ignorance où l’on se trouve de la voie de synthèse à emprunter. C’est la meilleure estimation que puisse faire le chimiste de la façon de synthétiser le composé cible.
[506] M. Wnuk niait qu’une analyse rétrosynthétique puisse s’employer de cette façon pour décrire les connaissances générales courantes sur la synthèse d’un composé nouveau qui ne mèneraient pas à une grande diversité de chemins et de voies secondaires, toutes comportant plus de recherches et d’expérimentation qui ne divulgueraient pas suffisamment comment réaliser le composé cible. J’accepte la déposition de M. Wnuk comme conforme au bon sens.
2) Les étapes de l’analyse rétrosynthétique d’Idenix
a) Une recherche documentaire
[507] Il n’existait pas de publication spécialisée qui montrait comment fabriquer le composé 2’‑C‑Me/F. C’est pourquoi MM. Griffon, Stewart et Clark ont tous eu à faire des recherches documentaires comme premier pas dans leur démarche de synthèse du nucléoside 2’‑C‑Me/F. M. Griffon aurait passé deux mois à mener un projet de recherche avant de proposer, le 27 juin 2002, d’entreprendre sa première tentative de synthèse. Ses notes montrent qu’il a constamment poursuivi ses recherches en raison de ses insuccès. M. Stewart a passé en moyenne deux heures par jour pendant six mois à mener des recherches pour synthétiser le composé 2’‑C‑Me/F. Quant à Jeremy Clark, il n’a pas pris de bonnes notes, et l’on ne sait au juste quelles recherches il a entreprises. Il semblerait qu’il a commencé par l’approche de la gemcitabine avant de passer à l’approche du nucléoside pour finir avec l’approche du cycle glucidique. D’après M. Patterson, il a reçu une aide considérable des chimistes expérimentés de Pharmasset, bien qu’ayant apparemment écarté les conseils que lui donnaient les chimistes principaux de recourir à l’approche du nucléoside. Il a réussi à synthétiser le nucléoside 2’‑C‑Me/F au moyen de cette dernière approche quelques mois après.
[508] Le recours aux publications comme point de départ de la fabrication d’un composé pour déterminer la voie de synthèse à emprunter diffère nettement de la description déjà soulignée de M. Damha plus haut d’une recherche documentaire [traduction] « effectuée pour vérifier les conditions de réaction aux diverses étapes du schéma de synthèse ». Outre le fait de démontrer l’inexistence de connaissances générales courantes sur la synthèse du composé 2’‑C‑Me/F, il est inconcevable que la divulgation du caractère réalisable soit suffisante si elle exige une série de recherches documentaires et une expérimentation à chaque étape, étant donné qu’il existe au départ trois voies de synthèse.
b) Laquelle des trois voies initiales de synthèse connues?
[509] M. Barrett a déclaré que trois choix s’offraient à la personne versée dans l’art au départ de la démarche de synthèse du composé 2’‑C‑Me/F. M. Wnuk était d’accord, et a expliqué ce que ces choix supposaient, et que je décrirai à la manière d’un abrégé :
[traduction]
1. On doit décider laquelle des trois stratégies suivre pour essayer de fabriquer la molécule : la stratégie de la petite molécule [l’approche de la gemcitabine], dans laquelle on fabrique un glucide à chaîne ouverte avec les substituants désirés, puis l’on forme le cycle glucidique à partir de cette chaîne ouverte pour ensuite tenter de fixer le cycle à la base désirée; la stratégie du cycle glucidique, dans laquelle la personne versée dans l’art prendrait d’abord un cycle glucidique disponible, tenterait d’y greffer les substituants désirés, puis fixerait le cycle à la base désirée; et la stratégie du nucléoside, dans laquelle la personne versée dans l’art prendrait d’abord un nucléoside disponible et tenterait d’y greffer les substituants désirés.
2. Dans chaque cas, la personne versée dans l’art aurait eu à choisir parmi de multiples produits de départ, réactifs, voies de synthèse, groupes protecteurs et conditions réactionnelles, et ce, à chaque étape de sa démarche.
[510] Les experts d’Idenix laissent entendre que la voie à emprunter aurait été évidente pour la personne versée dans l’art et que cette voie aurait été celle du cycle glucidique ou du nucléoside. La preuve des efforts déployés par M. Clark ne cadre pas avec la théorie d’Idenix. M. Clark aurait synthétisé le composé quelque sept mois après avoir d’abord discuté de l’idée avec la direction de Pharmasset et ensuite après avoir vainement appliqué l’approche de la gemcitabine. M. Watanabe lui aurait conseillé d’adopter l’approche du nucléoside. Cet avis était contraire à celui de M. Coe, ce qui démontre une fois de plus que tout le monde ignorait la voie de synthèse à suivre au départ. M. Griffon a aussi tenté sans succès d’emprunter la voie de la gemcitabine et, on le sait, il s’est engagé sans succès dans toutes les voies qui s’ouvraient à lui.
[511] M. Coe s’est ainsi exprimé :
[traduction]
D’après notre expérience et celle de bien d’autres [sic], plus particulièrement le groupe de de Clerc, les voies les plus praticables menant aux nucléosides fluorés sont les méthodes de condensation sucre‑base, sans égard au problème d’anomérisme, pour les raisons mêmes que vous avez découvertes, puisque les groupes partants produits in situ, par exemple dans les réactions au DAST, sont facilement attaqués par les nucléophiles du cycle pyrimidique ou par élimination et/ou participation de groupes bloquants. D’autres migrations de groupes sont facilement possibles : voir nos articles dans JFC 1993 62 145 et 1993 60 239. Cela dit, certaines des voies [sic] que vous avez essayées sont correctes, sauf que je crois que vous utilisez les mauvais réactifs et groupes partants et les mauvaises conditions réactionnelles.
[512] Cette mauvaise hypothèse s’est avérée bonne, les trois voies de synthèse s’étant au bout du compte révélées praticables. Il semble que M. Clark a d’abord synthétisé le composé par l’approche du cycle glucidique. Mais il a aussi utilisé l’approche du nucléoside avec de meilleurs rendements, ce qui a joué comme facteur pour amener M. Griffon à prendre cette même voie avec le Deoxo‑Fluor, forme plus stable du DAST. M. Stewart et Mme Wang n’ont eu du succès qu’après avoir appris que Pharmasset avait réussi à synthétiser le composé par l’approche du nucléoside. La réalité est que, avant d’avoir du succès, personne n’avait la moindre idée de la voie à suivre. Idenix n’était pas en mesure, d’après les connaissances générales courantes ou autrement, de divulguer une voie de synthèse à suivre en particulier en 2004.
c) Quelle voie de fluoration?
[513] M. Wnuk, seul expert connaissant la fluoration par expérience au moment pertinent, décrit le défi que devait relever le chimiste spécialisé dans la découverte pour juger de la voie de fluoration à suivre :
[traduction]
i) Par ailleurs, différentes réactions de fluoration avec une multiplicité d’agents fluorants s’offraient à la personne versée dans l’art en janvier 2004, mais on ne voyait pas bien comment fabriquer un nucléoside doté d’un 2’‑fluor (bas) et d’un 2’‑méthyl (haut). À l’époque, on comprenait que les réactions de fluoration s’effectuaient généralement par deux mécanismes : fluoration électrophile et fluoration nucléophile. Les produits de départ et les réactifs fluorants que demandait la fluoration électrophile différaient de ceux de la réaction nucléophile.
[514] M. Wnuk a mentionné que les agents fluorants connus le 8 janvier 2004 étaient notamment les suivants :
a) Fluoration électrophile : F2; SelectFluor; N‑fluorobenzènesulfonimide et ClO3F;
b) Fluoration nucléophile : HF et réactifs à base de HF (p. ex., HF‑pyridine, HF‑pyridine/AlF3, HF anhydre, HF/Fe(AcAc)3); AgF et réactifs à base d’AgF (AgF/NH4F); Et3N●3HF; KF et KF.
[515] Le choix de la réaction de fluoration (électrophile ou nucléophile) et, au bout du compte, de l’agent fluorant aurait influé sur le type de produit de départ à utiliser dans une voie donnée. Il aurait rendu la voie choisie plus complexe, puisque la personne versée dans l’art aurait eu à considérer un éventail de groupes protecteurs en fonction des différentes interactions entre les agents fluorants, leurs solutions et les conditions d’activité, ainsi que des interactions des composés précurseurs.
[516] J’estime que les éléments de preuve disponibles au 8 janvier 2004 étayent l’avis exprimé par M. Wnuk que rien n’enseignait à cette date comment fluorer un carbone tertiaire d’une manière stéréosélective en position 2’ d’un nucléoside. J’accepte aussi son témoignage selon lequel la possibilité de synthétiser un composé 2’‑C‑Me/F en utilisant une réaction de fluoration nucléophile ou, en fait, quelque méthode de fluoration que ce soit ne faisait pas partie des connaissances générales courantes.
[517] Aucun énoncé relevant des connaissances générales courantes ne pouvait être tiré de textes ou d’articles évalués par les pairs pour étayer l’opinion des experts d’Idenix que le DAST aurait été la voie à suivre en 2004 pour cette forme particulière de synthèse. Les opinions d’Idenix sont largement fondées sur le nombre d’articles recensés par suite de recherches documentaires concernant les procédés de fluoration en général, et aucun de ces articles ne décrit le DAST comme servant à la fluoration d’un carbone tertiaire dans un cycle ribose ou un nucléoside.
[518] Pour ce qui est des articles trouvés grâce aux recherches, M. Wnuk soulève plusieurs préoccupations concernant la puissance des recherches menées une décennie après les faits : [traduction] « d’après ma propre expérience, je sais que ces fonctions de recherche sont plus puissantes aujourd’hui qu’elles ne l’étaient il y a encore cinq ans ». C’est ce que semble démontrer M. Barrett dans son témoignage concernant les recherches qu’il a effectuées, telles qu’elles sont décrites au paragraphe 236 de son rapport de novembre :
[traduction]
Ainsi, et comme le montre la recherche initiale de Griffon, la position 3’ du nucléoside 41, par exemple, contient un groupe –CH(OH). J’ai répété cette recherche le 26 octobre 2014 dans SciFinder avec un filtre de 2002 ou avant et j’ai relevé 426 références, dont aucune ne parlait de nucléosides. Parmi ces références, 15 parlaient de réactions par le DAST (51) ou le Deoxo‑Fluor® (52). Reaxys (Beilstein Crossfire en 2002) est bien meilleure comme base de données que SciFinder pour une recherche sur les réactions. J’ai répété cette recherche le 26 octobre 2014 dans Reaxys avec un filtre de 2002 ou avant et j’ai relevé 44 références parlant de l’utilisation du DAST (51) ou du Deoxo‑Fluor® (52) ou d’un réactif sulfuré connexe pour la conversion d’un alcool tertiaire en un fluorure tertiaire. Il est intéressant de noter que Griffon n’a recensé que 48 références alors que j’en ai recensé 426.
[Non souligné dans l’original.]
[519] M. Wnuk conteste également les allégations de M. Barrett concernant les résultats de sa propre recherche. Il a relevé dans sept références (cinq articles et deux brevets) 32 réactions faisant appel au DAST comme réactif fluorant. Il a également recensé 10 références (trois articles et sept brevets) parlant de 25 réactions dans lesquelles le HF était le réactif fluorant. Il a donc conclu que le HF figurait dans plus de références que le DAST.
[520] M. Griffon a utilisé le HF comme réactif fluorant avant d’opter pour un schéma faisant appel au Deoxo‑Fluor®. Je suis d’avis que les publications à l’époque n’aiguillaient pas suffisamment la personne versée dans l’art vers la famille des réactifs DAST au moment d’entreprendre une nouvelle synthèse sans enseignements, seulement avec les connaissances générales courantes.
[521] M. Coe, expert du domaine consulté par Idenix sur ce même problème à l’époque, a proposé quatre méthodes pour synthétiser un nucléoside 2’‑C‑Me/F, aucune ne prévoyant la fluoration nucléophile d’un alcool tertiaire sur un sucre à l’aide du DAST ou d’un réactif équivalent. Il a mentionné incidemment le DAST dans sa lettre d’accompagnement comme exemple de sa recommandation d’adopter les produits de départ prévus dans l’approche du cycle glucidique au lieu de ceux prévus dans l’approche du nucléoside.
[522] Il est important de souligner qu’il n’a pas recommandé une expérience faisant appel au DAST ou au Deoxo‑Fluor® si l’on considère qu’il n’était pas fait mention de l’expérience du 13 février 2003 de M. Griffon dans la lettre du 9 février 2003 de M. Storer au sujet du composé qui constituait la cible 9 :
[traduction]
La cible 9 est une tentative de remplacer par un fluor l’OH tertiaire de l’analogue ribo. Nous avons essayé diverses procédures à partir de l’analogue méthylène exocyclique afin d’ajouter un HF à travers la double liaison. Nous n’avons eu aucun succès. Nous songeons maintenant à prendre le composé 2’‑α méthyle anhydre et à l’ouvrir avec un fluorure. Je n’ai pas grand espoir de succès. L’annexe 3 résume ce qui précède. J’apprécierais vos idées sur la façon d’introduire le substituant fluoro tertiaire dans le composé 1.
[523] Si Idenix a raison de dire que la voie de choix la plus évidente était celle faisant appel au DAST ou au Deoxo‑Fluor®, la lettre de M. Coe aurait dû présenter le schéma indiquant la nécessité d’inverser les substituants en position 2’ du cycle glucidique, etc. M. Coe ne mentionne le DAST que pour appuyer le choix de l’approche du cycle glucidique [traduction] « pour les raisons mêmes que vous avez découvertes, puisque les groupes partants produits in situ, par exemple dans les réactions au DAST, sont facilement attaqués par les nucléophiles du cycle pyrimidique ou par élimination et/ou participation de groupes bloquants ». D’après les experts d’Idenix, le DAST était la voie évidente à suivre pour toute analyse rétrosynthétique. Pourtant, il n’est pas même mentionné parmi les schémas suggérés par M. Coe. Cette constatation ne vise pas à jeter le discrédit sur M. Coe. Elle témoigne plutôt du fait que personne ne savait comment synthétiser le nucléoside 2’‑C‑Me/F avant que Jeremy Clark ne trouve une voie à suivre, apparemment avec une foule de conseils des chimistes principaux avec qui il travaillait.
[524] J’ai déjà dit que j’admettais l’exactitude du témoignage de M. Wnuk lorsqu’il disait ignorer l’existence de toute publication antérieure à 2005 décrivant l’utilisation du DAST ou du Deoxo‑Fluor® pour la fluoration stéréosélective d’un alcool tertiaire sur un nucléoside, plus particulièrement en position 2’ du cycle glucidique désoxy. À l’époque, on ignorait et n’aurait pu prédire avec quelque confiance que ce soit que le DAST ou le Deoxo‑Fluor® pourrait servir à fluorer un sucre (ou une entité glucidique) portant un méthyle en position 2’ (haut) ou 2’ (bas).
[525] M. Damha s’inscrit en faux, mais les exemples qu’il présente de structures stéréospécifiques de fluoration concernent largement un carbone secondaire, et les structures relatives aux carbones tertiaires ne ressemblent en rien à celles du cycle glucidique avec un méthyle (haut) en position 2’.
[526] M. Wnuk dit au paragraphe 129 et aux paragraphes suivants de son premier rapport que le résultat de l’utilisation d’agents du type DAST dépendait de la structure (notes de bas de page omises) :
[traduction]
Fait d’importance, il avait été démontré que le comportement de l’agent fluorant DAST/Deoxo‑Fluor® dépendait de la structure des composés sur lesquels il était utilisé. Plus précisément, on savait que la capacité du DAST/Deoxo‑Fluor® à produire un composé fluoré dépendait de la structure du produit de départ (alcool primaire, secondaire vs tertiaire; composé linéaire vs cyclique).
[527] Un exemple de fluoration tertiaire sur lequel s’appuient les experts d’Idenix figure dans l’article de Van Robays M. et al. (1986), J. Chem. Soc. Perkin Trans 1 : 251 à 254; cet article est également cité par M. Wnuk au sujet de l’imprévisibilité des résultats de la fluoration :
[528] Il y avait aussi un problème d’imprévisibilité des réactions au DAST. En janvier 2004, la personne versée dans l’art aurait su que les réactions de fluoration pouvaient donner des résultats imprévisibles. Tel était particulièrement le cas quand on essayait de synthétiser un nouveau nucléoside par un nouveau mode de substitution sur le cycle furanose. La personne versée dans l’art qui, le 8 janvier 2004, aurait tenté de fabriquer un nucléoside 2’‑C‑Me/F aurait connu cette situation. C’est ce qu’ont confirmé M. Clark et l’équipe des auteurs de Pharmasset dans leur article de 2005 :
[traduction]
La fluoration d’alcools tertiaires par le DAST a été décrite, mais la stéréochimie de telles transformations dépend du substrat et est fréquemment imprévisible. Yang et al. ont signalé, par exemple, que la fluoration au DAST d’un alcool tertiaire dans le 2‑bromométhyl‑DL‑myo‑inositol se traduisait par le maintien de la configuration. Wachtmeister et al. ont obtenu un 4‑fluoro ‑1‑cyclopentanol contenant un fluor tertiaire avec un rendement de 25 % en utilisant le DAST comme réactif fluorant et cette transformation se traduisait par une inversion de la configuration. De plus, les déshydratations ou éliminations, les réarrangements et les contractions de cycle sont souvent des problèmes omniprésents dans la fluoration au DAST de molécules hautement fonctionnalisées.
[529] Je conviens avec Idenix qu’il existait des articles où il était question de l’utilisation du DAST ou du Deoxo‑Fluor® dans la synthèse de glucides. Ainsi, les deux parties ont cité l’article de 2002 de Singh intitulé « Recent Advances in Nucleophilic Fluorination Reactions of Organic Compounds Using Deoxofluor and DAST » (l’article de Singh), pièce 35b. Le but de l’article était de [traduction] « récapituler les percées les plus récentes en matière d’introduction de groupes fluoro‑ ou fluorés dans des composés organiques en utilisant le Deoxo‑Fluor® et le DAST comme réactifs de fluoration nucléophile ». Interrogé sur le commentaire dans l’article où il est dit que [traduction] « les réactions de fluoration nucléophile de composés organiques par des réactifs fluorants comptent parmi les méthodes les plus répandues en chimie des fluors », M. Wnuk a répondu que la même chose se dirait de tout article où un réactif précis est examiné.
[traduction]
R. Oui. Mais je suis d’accord pour dire comment les articles de synthèse, bien sûr, écrits sur le DAST, donc si un article de synthèse était écrit sur un autre réactif fluorant comme le HF, il est fort probable que l’auteur aurait commencé en disant « Le réactif HF est largement utilisé », c’est une phrase d’introduction, n’est‑ce pas? C’est une façon tout à fait courante pour nous d’écrire un article de synthèse. Mais c’est vrai pour le DAST.
[530] En fait, si on dit [traduction] « un des plus largement utilisés », c’est qu’il devait y avoir d’autres méthodes largement utilisées, et c’était ce qu’affirmait M. Wnuk.
[531] Je n’estime pas que le contre‑interrogatoire de M. Wnuk ait établi quoi que ce soit d’autre que le fait que l’utilisation d’agents de type DAST pour la fluoration ne relevait pas des connaissances générales courantes pour la production d’un composé 2’‑C‑Me/F en 2004. En contre‑interrogatoire, M. Wnuk a passé en revue les réactions SN1 et SN2 avec les agents de type DAST. Il a reconnu qu’il était généralement admis qu’elles pouvaient produire une substitution et une fluoration en une seule étape à l’aide du composé intermédiaire 2’‑C‑OH/Me et que le résultat pouvait être un mélange contenant le composé cible.
[532] Ce faisant, M. Wnuk a été renvoyé à l’article de Singh à propos de l’article de Wachtmeister (la pièce 222) cité à la référence 22 dans les 13 exemples du tableau 2 décrit comme la [traduction] « Fluoration d’un groupe hydroxyle situé sur un cycle pyranoside », où un alcool tertiaire était fluoré de la manière suivante :
[533] M. Wnuk a fait observer que l’article de Wachtmeister et les articles connexes ne traitent pas de la fluoration en position 2’ du cycle glucidique ou du nucléoside. Il a précisé au paragraphe 237 de son premier rapport que, au contraire, ces articles parlent de fluoration en position 4’, position qui n’a pas la même réactivité et dont l’encombrement stérique est moindre (dans un nucléoside) que la position 2’ (à cause de la proximité de la base par rapport à la position 2’ du sucre). Qui plus est, ces articles traitent de nucléosides ou de sucres carbocycliques qui portent un CH2 et non un oxygène (O) dans le cycle ribose. La présence d’un oxygène au carbone adjacent influe souvent sur la fluoration.
[534] Je ne peux non plus m’empêcher de souligner que, dans l’article de Singh, au paragraphe comprenant le tableau et la citation de l’article de Wachtmeister, les auteurs signalent aux pages 2565 et 2566, dans leur description du DAST ou du Deoxo‑Fluor® utilisé comme réactif pour un cycle glucidique, les défis que posent de telles réactions :
[traduction]
Il n’existe qu’un très petit nombre de composés glucidiques fluorés naturels. La nucléocidine (53), un antibiotique isolé de Streptomyces clavus, en est un exemple. En raison du peu d’abondance naturelle, mais de la grande utilité et de l’acidité des glucides fluorés, leur synthèse est d’une grande importance. Toutefois, comme de nombreuses étapes de protection et de déprotection sont requises pour établir le groupe hydroxyle désiré en vue de sa substitution par le fluor, l’introduction d’un fluor dans une entité glucidique est difficile. Le Deoxofluor (1) et le DAST (2) ont été utilisés pour de telles molécules (tableau 2).
[Non souligné dans l’original.]
[535] Au cours de son contre‑interrogatoire, M. Wnuk a reconnu, comme il était attendu de lui en tant qu’expert assistant la Cour, que le regroupement de références diverses issues d’articles traitant d’une grande variété de situations a pu produire ce qui ne pouvait être à l’époque qu’une voie théorique de synthèse du composé 2’‑C‑Me/F. La Cour n’a nullement été persuadée par là que M. Wnuk, seul expert à témoigner qui possédait à l’époque une expertise dans le domaine de la fluoration de ces composés, n’avait pas raison de conclure à l’absence de connaissances générales courantes quant à l’opportunité d’emprunter la voie de la fluoration au DAST pour la synthèse du composé 2’‑C‑Me/F en 2004.
[536] Enfin, je conclus subsidiairement que le fait qu’un réactif retienne l’attention ou qu’il soit un premier choix ne constitue pas une connaissance générale courante et ne respecte pas les exigences de l’alinéa 27(3)b). Il ne peut en être autrement, car les essais courants ne peuvent servir à établir la justesse du choix. Pour faire partie des connaissances générales courantes regardant la synthèse d’un composé, la déclaration doit présenter un certain degré prédéterminé de quasi‑certitude que les essais courants pourront confirmer et non prouver. Le premier choix d’un réactif clé de synthèse ne serait pas non plus un fondement suffisant pour aller de l’avant.
[537] De même, selon l’alinéa 27(3)b), la description du mode de fabrication du composé doit être quasi‑certaine, en laissant une certaine latitude aux essais courants pour faire fonctionner l’invention. Autrement, l’obligation d’« exposer clairement les diverses phases […] de confection […] d’un composé de matières, dans des termes complets, clairs, concis et exacts » afin de permettre sa synthèse, ne serait pas respectée. Un énoncé tiré des connaissances générales courantes ne saurait être une description de la probabilité ni une prédiction valable du choix d’une voie ou d’un réactif clé à adopter pour synthétiser un composé. Cette invention ne présenterait pas assez de valeur sûre pour justifier un monopole.
d) Le toluène en tant que solvant des réactions au DAST
[538] Comme il est décrit dans l’extrait qui précède, M. Damha est d’avis que, une fois arrêté le choix du DAST, le reste est [traduction] « un essai courant par tâtonnement comme on peut s’attendre d’un chimiste versé dans l’art ». Ce point de vue s’applique tant au choix du toluène comme catalyseur qu’aux conditions de son emploi.
[539] À mon avis, le recours au toluène comme réactif soulève la question de savoir où s’arrêtent les connaissances générales courantes et où commencent les expériences par tâtonnement. Les conditions d’utilisation du toluène, si elles sont reconnues comme des connaissances générales courantes, pour les réactions au DAST dans les circonstances exigent néanmoins de décider si les expériences liées à son utilisation poseraient trop de difficultés.
[540] Quoi qu’il en soit, si l’utilisation du toluène est une question d’expérience par tâtonnement, j’estime, compte tenu de la preuve des experts, que son utilisation dans une synthèse réussie du composé 2’‑C‑Me/F poserait trop de difficultés.
[541] Je conviens avec M. Wnuk que ne faisait pas partie des connaissances générales courantes le fait que la synthèse du nucléoside 2’‑C‑Me/F à l’aide du DAST ou du Deoxo‑Fluor® exigeait les étapes critiques de l’utilisation de toluène comme solvant ou que la température de la solution devait être de ‑20 degrés comme dans la synthèse réussie de Jeremy Clark.
[542] La preuve d’Idenix concernant l’utilisation du toluène a été fournie par M. Damha aux paragraphes 247 et 248 de son rapport présenté en réplique :
[traduction]
[247] M. Wnuk dit aussi que le toluène n’est pas un solvant normalement choisi pour les réactions au DAST (paragraphe 212 de son rapport). C’est toutefois une affirmation contraire à deux articles cités dans son rapport. Dans l’article de Singh, [précité], les auteurs précisent que les applications du Deoxo‑Fluor et du DAST sont les méthodes les plus répandues pour introduire un fluor dans des composés organiques. Ces auteurs disent à la page 2576 :
Les fluorations à l’aide de 1 [Deoxofluor] et 2 [DAST] étaient le plus souvent réalisées dans des solvants anhydres comme le CH2 Cl2, le CHCl3, le CCl3 F, l’hexane, l’isooctane, le toluène, le H2O et le glyme.
[248] L’article de Yang S.S. et al. (1993) publié dans Carbohydrate Research 249:259‑263 est également citée dans le rapport de Wnuk. Il y est aussi question de l’utilisation du DAST dans le toluène. Ces références révèlent que le toluène était connu comme solvant pouvant être utilisé dans les fluorations au DAST au début des années 2000.
De toute manière, d’autres solvants comme le dichlorométhane (DCM; CH2Cl2) peuvent aussi servir à la fluoration au DAST. Quoi qu’il en soit, le choix du solvant est une autre question accessoire, car c’est un facteur que peut couramment modifier la personne versée dans l’art, et il ne permettrait pas de savoir si celle‑ci serait en mesure de procéder à une fluoration au DAST dans le cadre d’un essai courant.
[Non souligné dans l’original.]
[543] M. Wnuk souligne l’article de Singh lorsqu’il passe en revue les publications en voulant préciser que, dans tous les exemples de fluoration par le DAST ou le Deoxo‑Fluor®, le dichlorométhane était le solvant utilisé, et non le toluène. Dans l’article de synthèse de Singh, le toluène figure au cinquième ou au sixième rang des options d’après les articles de nombreux autres scientifiques ayant employé le DAST ou le Deoxo‑Fluor® pour la conversion. M. Wnuk fait observer que [traduction] « personne ne parle du toluène, et il s’agit des articles de nombreux autres scientifiques qui utilisaient le DAST pour la conversion ». Le seul article cité dans les publications où le toluène était utilisé avec le DAST semble être celui de M. Yang. L’article de Singh ne comporte aucune autre référence, ce qui explique peut‑être pourquoi le toluène se trouve à la fin de la liste des solvants utilisés avec les réactifs de type DAST.
[544] M. Wnuk fait également mention du caractère essentiel du choix du toluène comme solution pour le DAST et de la température de la réaction. L’article de Singh dit à la page 2562 que [traduction] « Pour la plupart des composés, la fluoration s’effectue sous la température ambiante, parfois même à une température aussi basse que ‑78 oC ». L’intervalle est presque de 100 oC. L’article de Yang mentionne que le toluène utilisé avec le DAST était chauffé de 10 à 15 minutes à une température de 70 à 75 oC.
[545] La Cour s’appuie aussi sur les observations de M. Wnuk aux paragraphes 190 à 194 de son premier rapport selon lesquelles l’utilisation du toluène à une température de 20 oC avec la base cytosine (au lieu de l’uracile) a joué un rôle essentiel dans la synthèse réussie du nucléoside 2’‑C‑Me/F par M. Stewart et de Mme Wang. Il semble qu’Idenix n’ait pas cherché à contredire cette preuve, sinon en s’opposant à l’introduction de la déposition de M. Stewart, mais non à celle de Mme Wang. Je reprends au long le témoignage de M. Wnuk parce qu’Idenix s’appuie sur le fait que ses employés ont finalement réussi à synthétiser le composé 2’‑C‑Me/F, bien qu’elle ait refusé d’admettre les transcriptions du témoignage de M. Stewart dans l’affaire entendue au Royaume‑Uni.
[traduction]
[190] Fait important, la réaction de fluoration dont parle M. Stewart à la page 135 de son carnet de laboratoire 081 a eu lieu dans un solvant au toluène. Comme le savait la personne versée dans l’art, le toluène n’est pas couramment utilisé comme solvant avec le DAST et n’aurait pas constitué le solvant de choix de la personne versée dans l’art pour effectuer des réactions de fluoration avec le DAST. Il convient de noter que le toluène n’a même pas été employé par M. Stewart dans ses tentatives antérieures avec le DAST. Néanmoins, le toluène est le solvant utilisé et décrit dans la publication WO de Clark pour obtenir avec le DAST des composés nucléosidiques 2’‑fluoro (bas), 2’‑méthyl (haut). Bien que je n’en sois pas certain, vu les conditions réactionnelles employées par M. Stewart, je pense qu’il s’est reporté aux instructions de la publication WO de Clark pour tenter de synthétiser le nucléoside 2’‑fluoro (bas), 2’‑méthyl (haut).
[191] De l’examen du carnet de Mme Wang, il ressort que, en décembre 2004, cette dernière a tenté la synthèse d’un nucléoside fluoré 2’‑méthyl (haut), 2’‑fluor (bas) à l’aide d’un composé nucléosidique contenant de l’uracile comme produit de départ. Elle voulait fluorer le nucléoside de départ avec du DAST (dans un solvant de dichlorométhane), mais a échoué à cause d’une réorganisation qui, comme je l’ai déjà mentionné, se produit fréquemment lorsqu’on utilise ce réactif.
[192] En janvier 2005, Mme Wang a commencé à utiliser un autre composé nucléosidique contenant de la cytosine (au lieu de l’uracile) comme produit de départ pour la réaction de fluoration. Je signale que, au 13 janvier 2005, la publication WO de Clark avait déjà été publiée et suggérait d’utiliser comme produit de départ des composés nucléosidiques ayant une cytosine protégée comme base. Mme Wang a protégé le composé nucléosidique porteur d’une cytosine (p. ex., aux positions 3’ et 5’ de l’entité glucidique ainsi que de la base) en employant les mêmes groupes protecteurs que ceux proposés dans la publication WO de Clark. Elle a ensuite produit un intermédiaire contenant une cétone en position 2’ du cycle glucidique du nucléoside protégé afin d’introduire un substituant méthyle en position 2’ (bas) de l’entité glucidique par la méthode décrite dans la publication WO de Clark. Après introduction du substituant méthyle en position 2’ (bas), elle a remplacé les groupes protecteurs aux positions 3’ et 5’ de l’entité glucidique par ceux proposés dans la publication WO de Clark. Enfin, en mars 2005, elle a tenté de fluorer un composé nucléosidique protégé en position 2’ à l’aide du DAST dans les conditions décrites dans la publication WO de Clark.
[193] Je note que la réaction de fluoration évoquée par Mme Wang dans son entrée du 9 mars 2005 de son carnet de laboratoire a eu lieu dans du toluène à une température de ‑20 oC. Comme je l’ai dit, le toluène n’aurait pas été considéré comme le solvant de choix pour des réactions de fluoration à l’aide du DAST. Le toluène était néanmoins le solvant utilisé et décrit dans la publication WO de Clark en vue de l’obtention de composés nucléosidiques 2’‑fluoro (bas), 2’‑méthyl (haut).
[194] Il est intéressant de souligner que, dans son carnet de laboratoire 073, Mme Wang fait mention du procédé du « brevet » ou du « brevet de Pharmasset » sans donner la référence exacte d’un tel document. Il semble toutefois que cette mention concerne probablement le procédé et la méthodologie que décrit la publication WO de Clark, puisque Mme Wang semble avoir appliqué les conditions expérimentales proposées par cette publication.
3) L’embarras du choix
[546] Reconnaissant le grand nombre de choix qui s’offrent à la personne qui s’apprête à synthétiser le composé 2’‑C‑Me/F, M. Damha dit ce qui suit au paragraphe 250 de son rapport en réponse :
[traduction]
[250] Malgré la pléthore de publications à la disposition de la personne versée dans l’art, M. Wnuk y va aussi de commentaires à l’emporte-pièce selon lesquels un grand nombre de voies possibles doivent être essayées, tout comme un grand nombre d’agents fluorants et autres réactifs tout au long du processus sans attente de succès (paragraphes 112 à 115). Je ne pense pas que l’embarras du choix signifie qu’une transformation donnée ne serait pas courante. En fait, les options donnent au chimiste un filet de sécurité au cas inattendu où l’une d’entre elles ne fonctionnerait pas comme prévu. Plus important encore, ces commentaires font fi des schémas du brevet 191 concernant les nucléosides 2’ pouvant logiquement servir de point de départ. Dans la mesure où M. Wnuk laisse entendre qu’il y a d’autres façons de convertir un alcool en fluor dans un nucléoside, je suis d’accord. Mais son argument tourne court s’il ne prouve pas que ces autres façons ne donnent aucun résultat – ce qu’il n’a pas fait.
[Non souligné dans l’original.]
[547] La preuve n’étaye pas le point de vue de M. Damha. L’existence d’une pléthore de publications exposant les choix existants à la personne versée dans l’art ne permet pas de savoir si la synthèse du composé faisait partie des connaissances générales courantes. Il est certain qu’il n’y a pas d’essais courants par tâtonnement là où il y a l’embarras du choix, sans compter que cela exclut totalement la possibilité que la divulgation du composé 2’‑C‑Me/F se fasse par l’intermédiaire des connaissances générales courantes. De plus, j’ai déjà fait remarquer que les informations minimales qu’il est possible d’inférer à partir du brevet 191 ne constituent pas un point de départ logique pour la synthèse du composé 2’‑C‑Me/F, contrairement à ce qu’affirme M. Damha.
[548] Je ne suis pas non plus d’accord pour dire que le témoignage de M. Wnuk puisse être caractérisé comme démontrant l’existence d’autres moyens de convertir un alcool en fluor dans un nucléoside. Son témoignage a démontré qu’Idenix ne s’était pas acquittée de son obligation de divulguer comment effectuer la synthèse du composé 2’‑C‑Me/F. Il a conclu que le fait que les étapes individuelles d’une synthèse chimique puissent rétrospectivement trouver des précédents dans les publications scientifiques ne signifie pas que la séquence globale des étapes de fabrication d’un nouveau composé était facile à établir. La plupart des nouveaux composés sont fabriqués à l’aide de réactifs et de méthodes déjà décrits dans les publications. Néanmoins, il faut souvent beaucoup de créativité et/ou d’expérimentation pour établir la bonne séquence des réactions à réaliser et les réactifs à employer à chaque étape. Je souscris à ces avis, sans rien conclure quant à la question de savoir si la fabrication du composé 2’‑C‑Me/F constituait une étape inventive.
4) L’invocation des travaux de Pharmasset
[549] Je conviens avec Gilead qu’Idenix ne peut s’appuyer sur ce que Pharmasset avait accompli, et dont elle n’avait pas connaissance à la date de publication de la demande. Vu l’absence de publications décrivant ou d’information expliquant comment synthétiser le composé 2’‑C‑Me/F, il n’y avait pas de connaissances générales courantes montrant qu’il existait une manière de le synthétiser.
E. Les travaux de M. Griffon
[550] M. Griffon est un personnage essentiel dans le présent litige, et ce, pour un certain nombre de raisons. D’abord, il a tenté de synthétiser le composé 2’‑C‑Me/F avec une grande variété d’agents de fluoration sans succès pendant une période de près de deux ans. Ses échecs prouvent donc en temps réel qu’Idenix ne pouvait pas synthétiser le composé en s’appuyant sur les connaissances générales courantes et des essais courants par tâtonnement.
[551] Deuxièmement, c’est pour cette raison même, et en écartant tout le reste, qu’Idenix ne peut pas avoir gain de cause si elle est incapable d’expliquer les échecs de M. Griffon. Idenix fait valoir que ce dernier ne s’est pas conduit comme l’aurait fait un chimiste versé dans l’art, et qu’il a d’ailleurs dénaturé les résultats de ses expériences, empêchant ainsi ses superviseurs de corriger ses prétendues erreurs.
[552] Troisièmement, et corollaire un peu gênant de sa présumée incompétence, Idenix tente aussi de démontrer que M. Griffon a réussi à synthétiser le composé sans le savoir. Idenix essaie de le prouver en invoquant une simulation qu’AMRI aurait faite de l’expérience réalisée en février 2003 par M. Griffon avec le Deoxo‑Fluor® pour synthétiser le nucléoside 2’‑C‑Me/F. J’examinerai toutes ces affirmations ci‑après.
1) Les tentatives de M. Griffon de synthétiser le composé 2’‑C‑Me/F
a) Le Dr Griffon et le groupe des analogues nucléosidiques d’Idenix
[553] M. Griffon est un chimiste de synthèse expérimenté qui a synthétisé des centaines de molécules, la plupart des nucléosides, pendant sa formation et son séjour chez Idenix. De 1994 à 1998, il a fait son doctorat au laboratoire de M. Jean‑Louis Imbach à Montpellier, où son directeur de thèse était M. Gilles Gosselin. Les deux sont reconnus comme des chimistes principaux très compétents dans leurs domaines. En cours de thèse, M. Griffon a fabriqué un certain nombre de nucléosides substitués par un fluor aux positions 2’ et 3’. Après le doctorat, il a fait un stage postdoctoral de deux ans au Southern Research Institute de Birmingham, en Alabama, dans un laboratoire dirigé par un spécialiste bien connu des nucléosides, M. Jack Secrist.
[554] Il est entré chez Idenix en février 2001 à Montpellier, en France, et a été affecté au groupe des analogues nucléosidiques. À l’époque, son directeur de thèse, M. Gosselin, était directeur de recherche chez Idenix. En 2004 ou vers cette année, les responsabilités professionnelles de M. Griffon comprenaient notamment des recherches documentaires, l’élaboration et l’application de nouvelles stratégies de synthèse et l’analyse des produits réactionnels.
[555] M. Griffon faisait ses propres analyses de chromatographie sur couche mince (CCM) et avait accès aux appareils de RMN et de spectrométrie de masse (SM) à Montpellier. Il n’a cependant pas eu accès à la chromatographie en phase liquide couplée à la spectrométrie de masse (CPL‑SM) avant 2006 (méthode qui combine en une seule étape la séparation et la caractérisation des produits réactionnels).
[556] M. Griffon rendait directement compte à M. Gosselin et à M. Storer, vice‑président directeur, Chimie, chez Idenix, qui partageait son temps entre Montpellier, en France, et Cambridge, au Massachusetts.
[557] MM. Gosselin et Storer dirigeaient les travaux de chimie chez Idenix. Le rôle de M. Griffon consistait en partie à travailler avec eux à de nouveaux composés et à juger si de nouveaux composés pouvaient être synthétisés. Pour ce faire, il devait examiner les publications scientifiques et, si nécessaire, les adapter en vue de nouvelles applications.
[558] M. Griffon s’est vu confier la tâche de synthétiser un nucléoside 2’‑C‑Me/F en mars 2002. Au début, ce composé n’était pas sa priorité, mais en juillet 2002, il était devenu [traduction] « hautement prioritaire ». M. Griffon comptait sur l’aide d’Audrey Chappe, technicienne de laboratoire, et d’Élodie Pécheux, stagiaire.
[559] M. Griffon et ses assistants ont planifié et appliqué un certain nombre de stratégies générales pour la synthèse d’un composé 2’‑C‑Me/F du mois de mars 2002 à l’été 2004. De 2002 à 2004, le groupe des analogues nucléosidiques d’Idenix Montpellier était formé de MM. Griffon, Storer et Gosselin. Ceux‑ci se réunissaient tous les deux mois pour examiner les progrès accomplis et établir des molécules cibles et des échéanciers. Ces réunions duraient de deux à quatre heures en moyenne et étaient résumées dans une série de rapports qui étaient ensuite distribués aux chimistes.
[560] En plus de ces réunions de groupe, M. Griffon rencontrait aussi directement M. Storer et discutait souvent de problèmes ou de questions de chimie avec les autres chimistes d’Idenix titulaires d’un doctorat, notamment David Dukhan, Frédéric Leroy et Jean‑Christophe Meillon.
[561] Les travaux de M. Griffon étaient résumés dans des rapports mensuels dont MM. Storer et Gosselin recevaient copie tous les mois, et parfois M. Imbach. L’objet de ces rapports était d’expliquer les activités et les accomplissements de M. Griffon en matière de synthèse. M. Griffon estime que ses carnets de laboratoire et ses rapports mensuels donnent une idée exacte de ses tentatives de synthèse. Lors du contre‑interrogatoire, il a reconnu qu’il ne pouvait pas se souvenir clairement des travaux qu’il avait effectués de 2002 à 2004 sans consulter les documents.
[562] En plus de ses rapports mensuels, M. Griffon a résumé ses travaux de synthèse et ses recherches documentaires dans un rapport élaboré en fin de projet. Dans ce dernier rapport, il a rendu compte de ses expériences, dont beaucoup avaient eu lieu à quelques reprises, dans des conditions de réaction différentes et avec un mélange d’agents de fluoration nucléophile et électrophile.
[563] Le 28 mars 2002, à l’occasion d’une rencontre de chimie d’Idenix à Montpellier où étaient notamment présents MM. Storer, Gosselin et Imbach, M. Griffon s’est vu confier la tâche de synthétiser un nucléoside 2’‑C‑Me/F. À l’époque, sa priorité était de créer un nucléoside 2’‑méthoxy (aussi appelé OCH3) (bas). On lui a aussi demandé de créer d’autres nucléosides porteurs d’un 2’‑méthyl (haut) et de divers groupes en position 2’ (bas). De 2002 à 2004, il a aussi travaillé à d’autres projets.
b) Les recherches dans les publications
[564] M. Griffon a commencé par effectuer des recherches dans les publications; il semble qu’il en a été question lors de la rencontre de chimie de mai 2002 d’Idenix qui s’est déroulée à Montpellier. Idenix a critiqué la manière dont il effectuait ses recherches documentaires, car elles étaient trop restrictives pour ce qui était des substituants saisis dans le moteur de recherche Scifinder, de sorte qu’il n’avait pas trouvé autant d’articles pertinents qu’il aurait pu trouver s’il s’y était pris correctement. J’y reviendrai plus loin.
[565] Les résultats des recherches documentaires de M. Griffon ont été présentés dans un rapport à Idenix le 27 juin 2002. Sa recherche initiale avec une formule générale pour des nucléosides 2’‑méthyl-2’‑substitués (avec un groupe méthyle en 2’ (haut) et divers groupes en 2’ (bas), dont un fluor tertiaire) n’avait donné aucun résultat. C’est pourquoi il a compris à l’époque qu’il lui était demandé de faire une synthèse nouvelle.
[566] Il a aussi entrepris une recherche avec une formule générale pour une structure à fluorure tertiaire. Il a expliqué qu’il l’avait fait parce qu’il ne pouvait trouver aucune référence concernant un sucre ou un nucléoside avec un groupe fluoro-méthyle (avec un groupe méthyle et un atome de fluor fixés comme substituants au même carbone) et avait donc étendu sa recherche à des structures plus générales. Il a obtenu 48 résultats concernant un fluor tertiaire.
[567] M. Griffon a affiné sa recherche de façon à trouver des documents traitant de la fluoration d’un alcool tertiaire et obtenu deux résultats. Pour affiner encore davantage sa recherche, il a tenté de recenser des documents concernant la transformation d’un époxyde en une molécule linéaire contenant un fluor tertiaire et a obtenu deux résultats. Il a mené ces recherches afin de trouver des stratégies possibles pour introduire un atome de fluor en position 2’.
[568] Fort de toutes ses recherches, M. Griffon a proposé une voie de synthèse de nucléosides 2’‑C‑Me/F dans son rapport de juin 2002. Cette voie reposait sur des stratégies de synthèse permettant d’installer un fluor en position 4’. Dans son rapport, M. Griffon faisait état des documents scientifiques concernant des dérivés nucléosidiques fluorés en position 4’ avant d’énoncer sa proposition, soit une stratégie basée sur un nucléoside 2’‑éthényl.
[569] En juillet 2002, le projet de synthèse de nucléosides 2’‑C‑Me/F était décrit comme [traduction] « hautement prioritaire » dans le résumé d’un exposé de M. Griffon donné à cette époque à l’occasion de la réunion de chimie d’Idenix à Montpellier. Dans ce résumé, M. Griffon disait qu’il fallait affiner la stratégie de synthèse proposée pour pouvoir la lancer le plus tôt possible.
[570] En contre‑interrogatoire, M. Griffon a expliqué que cette haute priorité signifiait que [traduction] « les principaux efforts de ma part ou d’Audrey [Chappe] en chimie » devaient se porter sur le nucléoside 2’‑C‑Me/F. C’est ce que confirme le résumé d’une rencontre de chimie d’Idenix à Montpellier qui a eu lieu peu après en juillet 2002 et où le composé cible 2’‑C‑Me/F a été décrit comme [traduction] « une nouvelle priorité de synthèse pour Jean‑François Griffon », ce qui correspond au souvenir que conserve l’intéressé du projet à l’époque.
[571] À compter de septembre 2002, il a proposé une succession de stratégies avec différents agents de fluoration pour la synthèse du composé 2’‑C‑Me/F. Les stratégies 1 à 6 relevaient de l’approche du nucléoside et les autres, de l’approche du cycle glucidique.
c) Les premières tentatives de synthèse du nucléoside 2’‑C‑Me/F
[572] M. Griffon a d’abord proposé une stratégie basée sur un nucléoside 2’‑éthényl et avec le fluorure d’argent (AgF) comme réactif fluorant. Il a constaté que seuls deux composés avaient été synthétisés et qu’aucun n’était le nucléoside fluoré désiré.
[573] À la lumière de ce constat, il a présenté deux autres propositions tablant sur l’approche du nucléoside dans son rapport de septembre 2002. L’une de ces propositions portait sur un nucléoside 2’‑éthényl avec le HF/pyridine AlF3 comme réactif fluorant. Dans l’autre, il envisageait la réduction d’un nucléoside 2’‑iodométhyl (bas) anhydre protégé (qui était un produit non désiré de sa stratégie infructueuse avec le 2’‑éthényle), suivie de la fluoration du nucléoside 2’‑méthyl (bas) anhydre protégé par le HF/pyridine AlF3. Aucune de ces deux propositions n’a eu de succès, comme le signalent les rapports de novembre et décembre 2002.
[574] M. Griffon a rencontré MM. Storer et Gosselin et le professeur Fleet en décembre 2002. Il a été question de ses travaux concernant la stratégie du nucléoside 2’-anhydre, et le professeur Fleet a proposé une stratégie de synthèse comportant l’utilisation d’une source de fluor positif (réactif de fluoration électrophile) réagissant avec une double liaison carbone‑carbone dans un sucre. Gilead fait observer que le professeur Fleet, qui est reconnu comme un brillant spécialiste de la chimie des glucides, n’a pas proposé la fluoration d’un alcool tertiaire avec le DAST ou le Deoxo‑Fluor®.
[575] En janvier 2003, M. Griffon a poursuivi ses travaux de synthèse d’un nucléoside 2’‑C‑Me/F. Dans son rapport d’étape, il dit que [traduction] « lorsque nous avons commencé par le dérivé du nucléoside 2’‑éthényl [stratégies 1 et 2] […] toutes les conditions expérimentales essayées ont échoué ». Il a aussi dit être incapable de mener à bien la réduction, première étape de sa troisième stratégie.
[576] Dans son rapport de janvier, M. Griffon a mentionné qu’il ferait des tentatives avec un nucléoside non protégé dans plusieurs conditions expérimentales. Les diverses tentatives comportaient une fluoration avec i) HF‑pyridine, AlF3 à 80 et 120 oC (stratégie 3 précitée, mais sans protection en 3’ et 5’); ii) KF, Kryptofix 2.2.2, pTsOH, DMF, reflux (stratégie 4); iii) KHF2 à reflux dans l’éthylèneglycol ou le 2‑méthoxyéthanol (stratégie 5). Dans le rapport d’étape de février 2003, M. Griffon précise qu’aucune de ces tentatives n’avait eu de succès.
d) La lettre de demande d’aide à M. Coe pour l’étape de la fluoration
[577] En février 2003, M. Storer d’Idenix a écrit à M. Coe, conseiller dont la Cour a reconnu l’expertise en chimie des fluors. Dans cette lettre, M. Storer décrivait un certain nombre de cibles d’intérêt pour Idenix en sollicitant les suggestions de M. Coe sur les façons possibles de les synthétiser. Au premier paragraphe, il disait [traduction] : « Ça va pour la chimie des nucléosides, mais c’est la chimie des fluors qui nous donne du mal et votre aide nous serait précieuse dans ce domaine. » Dans la partie de sa lettre traitant des analogues nucléosidiques, M. Storer écrivait [traduction] : « Nous avons un certain nombre de nucléosides cibles contenant un fluor, et la plupart nous donnent du mal. Les composés cibles sont tous des ribonucléosides d’un type ou d’un autre et portent un substituant supplémentaire en position 2’, le plus souvent un groupe méthyle. »
[578] M. Storer s’est alors étendu sur le sujet du nucléoside 2’‑C‑Me/F, le décrivant comme [traduction] « une tentative de remplacer par un fluor l’OH tertiaire de l’analogue ribo ». Il s’exprimait ainsi :
[traduction]
Nous avons essayé diverses procédures à partir de l’analogue méthylène exocyclique afin d’ajouter un HF à travers la double liaison. Nous n’avons eu aucun succès. Nous songeons maintenant à prendre le composé 2’‑α méthyl anhydre et à l’ouvrir avec un fluorure. Je n’ai pas grand espoir de succès. L’annexe 3 résume ce qui précède. J’aimerais savoir quelles sont vos idées sur la façon d’introduire le substituant fluoro tertiaire dans le composé 1.
e) La fluoration par le Deoxo‑Fluor du nucléoside D‑ribose à base uracile
[579] Dans son rapport d’étape de février 2003, M. Griffon résume aussi la création d’un nucléoside 2’‑C‑OH/Me protégé en 3’ et 5’, suivie de sa fluoration au Deoxo‑Fluor® (aussi décrit dans ce rapport sous le nom de trifluorure de bis‑(2‑méthoxyéthylamino) soufre). C’est l’expérience qu’a tenté de simuler AMRI en 2014. M. Damha a affirmé que le Deoxo‑Fluor® ressemble fort au DAST et est thermiquement plus stable que celui‑ci dans un intervalle de températures. La synthèse proposée par M. Griffon était fondée sur l’article de Wachtmeister où le groupe hydroxyle tertiaire en C‑4 du nucléoside 2’‑C‑OH/Me intermédiaire approprié (molécule 5) était remplacé par un fluor à l’aide du Deoxo‑Fluor®. L’étape de la fluoration dans cette stratégie est mise en évidence dans le diagramme qui suit :
[580] Dans son rapport d’étape de février 2003, M. Griffon estime que, en ce qui concerne son expérience avec le Deoxo‑Fluor®, [traduction] « un nouveau composé s’est formé en cours de réaction », et il l’a identifié comme un composé avec une double liaison carbone‑carbone en position 2’ (dérivé du 2’‑éthényl). Il était d’avis à l’époque que la réaction avait échoué. Il l’a répétée le 19 février 2003 dans des conditions légèrement différentes. Idenix fait valoir que, en réalité, le nucléoside 2’‑C‑Me/F a été synthétisé au cours de cette expérience. Idenix se montre hautement critique à l’endroit de M. Griffon pour ce qui est de son défaut de séparer et d’analyser les résultats, ce dont je parlerai en détail ci‑après.
f) Le LiF et le TBAF comme réactifs fluorants en mars 2003
[581] En mars 2003, M. Griffon a présenté deux nouvelles propositions pour le projet 2’‑C‑Me/F. Il proposait d’abord une stratégie basée sur un nucléoside 2’‑anhydro non protégé et le LiF comme réactif fluorant. Il proposait ensuite une stratégie basée sur un nucléoside 2’‑méthyl-arabino faisant appel au (CF3SO2) 2 O pour fabriquer un intermédiaire et au TBAF comme réactif fluorant pour le déplacement de l’intermédiaire sur un nucléoside protégé.
[582] Dans son rapport d’étape d’avril 2003, M. Griffon dit que la réaction visant à fluorer un nucléoside 2’‑anhydro non protégé à l’aide du LiF qu’il avait proposée en mars 2003 était un échec.
g) M. Griffon assiste à un cours sur la fluoration
[583] Du 1er au 4 avril 2003, M. Griffon a assisté à un cours sur la fluoration à Stratford‑upon‑Avon avec une de ses collègues d’Idenix, Mme Claire Pierra. Ils ont résumé ce qu’ils avaient appris à ce cours dans un rapport envoyé à M. Storer, qui l’a lui‑même transmis par la suite à d’autres chimistes d’Idenix. Leur courriel disait [traduction] : « Nous nous sommes attachés aux sources de fluoration électrophile et nucléophile parce que nous pensions que c’était la partie la plus intéressante pour nos travaux de chimie en cours. » Le cours, intitulé « Making and Using Fluoroorganic Molecules », était donné par le professeur Jonathan Percy et Mme Alison Stuart. Le rapport passait en revue un grand nombre de réactifs de fluoration électrophile ou nucléophile et précisait les applications possibles de certains de ces réactifs pour la synthèse des composés cibles d’Idenix. Il ne semble pas y avoir été particulièrement question des réactifs de type DAST.
h) La réplique de M. Coe
[584] Le 9 avril 2003, M. Coe a répondu à la lettre que M. Storer lui avait envoyée en février de la même année. Il y évoquait les [traduction] « problèmes plus intéressants liés aux nucléosides » et déclarait ce qui suit :
[traduction]
D’après notre expérience et celle de bien d’autres, plus particulièrement le groupe de de Clerc, les voies les plus praticables menant aux nucléosides fluorés sont les méthodes de condensation sucre‑base, sans égard au problème d’anomérisme, pour les raisons mêmes que vous avez découvertes, puisque les groupes partants produits in situ, par exemple dans les réactions au DAST, sont facilement attaqués par les nucléophiles du cycle pyrimidique ou par élimination et/ou participation de groupes bloquants. D’autres migrations de groupes sont facilement possibles. Voir nos articles dans JFC 1993 62 145 et 1993 60 239. Cela dit, certaines des voies que vous avez essayées sont correctes, sauf que je crois que vous utilisez les mauvais réactifs et groupes partants et les mauvaises conditions réactionnelles.
[585] M. Coe a alors proposé quatre voies de synthèse du composé cible 2’‑C‑Me/F. Aucune des méthodes proposées ne prévoyait de fluoration d’un alcool tertiaire (en particulier, un nucléoside ou sucre 2’‑C‑Me/F) avec le DAST ou le Deoxo‑Fluor®.
a. La méthode 1 prévoyait la fluoration d’un sucre 2’‑méthyl (bas), 2’‑hydroxyl (haut) en utilisant le sulfonylimidazole comme intermédiaire et l’Et3N●3HFE comme réactif fluorant.
b. La méthode 2 ressemblait à la méthode 1, avec le sulfonylimidazole comme intermédiaire, mais le produit de départ était un nucléoside au lieu d’un sucre.
c. La méthode 3 prévoyait la fluoration d’un nucléoside 2’‑anhydro à l’aide de fluorure d’hydrogène anhydre ou de Bu4NH2F.
d. La méthode 4 prévoyait la réaction d’un alcool tertiaire avec le réactif pyridine/HF.
i) Les travaux de M. Griffon de mai 2003 à juillet 2004
[586] Un résumé de la rencontre de chimie d’Idenix à Montpellier en mai 2003 précise que le projet de synthèse d’un composé 2’‑C‑Me/F était [traduction] « toujours hautement prioritaire » à ce moment‑là.
[587] Dans son rapport d’étape de mai 2003, M. Griffon dit avoir fait [traduction] « des tentatives d’introduction de l’atome de fluor en position 2’ (bas) en suivant le rapport de Paul Coe ».
[588] Une des stratégies décrites par M. Griffon dans son rapport d’étape de mai 2003 est celle d’un nucléoside 2’-méthyl-arabino avec le sulfonylimidazole comme intermédiaire et l’Et3N●3HF comme réactif fluorant, adaptée à partir de la recommandation de M. Coe. M. Griffon a déterminé que cette étape était un échec.
[589] Dans son rapport de mai 2003, M. Griffon déclare que, lorsqu’il a tenté l’étape de fluoration de cette stratégie, [traduction] « aucune réaction n’a eu lieu; le produit de départ a été récupéré en grande partie ».
[590] L’autre stratégie décrite par M. Griffon dans son rapport d’étape de mai 2003 dans la section où il fait référence au rapport de M. Coe était celle d’un nucléoside 2’‑anhydro avec du Bu4NH2F comme réactif fluorant. M. Coe avait proposé cette réaction dans sa lettre d’avril 2003, dans la méthode 3.
[591] En juillet 2003 ou vers ce mois, M. Griffon a préparé un résumé des travaux qu’il avait réalisés de septembre 2002 à mai 2003 dans le cadre du projet de synthèse du composé 2’‑C‑Me/F. Dans ce rapport, il proposait aussi une stratégie de fluoration électrophile d’un sucre, comportant la fluoration d’une double liaison 1,2 avec un réactif électrophile, Selectfluor.
[592] Le résumé de la rencontre de chimie d’Idenix à Montpellier en juillet 2003 révèle que le projet 2’‑C‑Me/F était [traduction] « toujours hautement prioritaire » à l’époque. Le résumé dit aussi que [traduction] « une stratégie dans laquelle nous commencerions par le sucre fluoré correspondant pourrait être la solution » et que [traduction] « jusqu’à présent, toutes les procédures avec un nucléoside comme produit de départ ont échoué ».
[593] Dans son rapport d’étape de juillet‑août 2003, M. Griffon confirme l’échec de la stratégie du nucléoside 2’‑anhydro avec le Bu4NH2F proposée dans le rapport de M. Coe.
[594] Les rapports d’étape de septembre 2003 à janvier 2004 ne font état d’aucun travail dans le cadre du projet 2’‑C‑Me/F. Le projet a été suspendu à la rencontre de chimie d’Idenix à Montpellier tenue le 5 novembre 2003.
[595] En février 2004, M. Griffon a repris ses travaux sur le projet 2’‑C‑Me/F en essayant une nouvelle stratégie fondée sur le nucléoside 2’-éthényl, soit la fluoration de nucléosides à base protégée. En février 2004, il déclarait que cette stratégie était un échec.
[596] En mars 2004, M. Griffon a envoyé un rapport à M. Gosselin au sujet des diverses stratégies qu’il avait essayées et proposait des stratégies avec un sucre comme produit de départ. M. Gosselin a relayé ce rapport aux autres membres de l’équipe de Montpellier en sollicitant la contribution de chacun au projet.
[597] Le résumé de la rencontre de chimie du 21 avril 2004 à laquelle ont assisté MM. Storer, Gosselin et Griffon précisait que trois stratégies différentes basées sur un sucre étaient à l’essai pour la synthèse d’un sucre 2’‑C‑Me/F. Les stratégies proposées étaient les suivantes :
a. Ouverture d’un spiro α‑chloroépoxyde dans un sucre.
b. Ajout d’un agent de fluoration électrophile sur une double liaison 1,2 du sucre
c. Synthèse totale du synthon glucidique.
[598] Dans son rapport d’étape d’avril 2004, M. Griffon fait état de ses travaux relatifs à ces stratégies. Il discute de l’ouverture d’un spiro α‑chloroépoxyde sur un sucre et décrit la stratégie en question comme ayant été élaborée en collaboration avec David Dukhan, Ph. D., chimiste chez Idenix. Il déclare que, jusque‑là, ils ont été incapables de synthétiser le précurseur désiré pour l’étape de la fluoration.
[599] L’essai de la stratégie de fluoration électrophile d’une double liaison 1,2 sur un sucre à l’aide de Selectfluor était aussi en cours en avril 2004, et M. Griffon signale que, jusque‑là, cette stratégie a été infructueuse.
[600] Enfin, dans son rapport d’étape d’avril 2004, M. Griffon parle aussi de la stratégie de la synthèse totale du synthon glucidique. C’était là la stratégie du sucre fondée sur la méthode de fabrication de la gemcitabine. L’essai de cette stratégie était en cours en avril 2004.
[601] En mai 2004, la stratégie d’ouverture d’un spiro α‑chloroépoxyde sur un sucre était [traduction] « en veilleuse », ce qui veut dire que M. Griffon avait mis fin à tout essai de cette stratégie.
[602] Dans son rapport d’étape de mai 2004, M. Griffon signale également l’échec de sa tentative d’adjonction d’un réactif de fluoration électrophile à une double liaison 1,2 d’un sucre.
[603] Les travaux de synthèse totale du synthon glucidique (gemcitabine) se poursuivaient en juin 2004.
[604] En juillet 2004, M. Griffon a fait une nouvelle tentative de fluoration électrophile d’une double liaison 1,2 d’un sucre, mais sans pouvoir produire de composé comportant un fluor.
[605] Les travaux de synthèse totale du synthon glucidique (gemcitabine) se sont poursuivis en juillet 2004, mais la condensation aldolique a échoué.
[606] Les rapports d’étape ultérieurs de M. Griffon semblent révéler qu’aucuns travaux sur le projet 2’‑C‑Me/F n’ont eu lieu après juillet 2004.
[607] À la fin du projet, M. Griffon a préparé un rapport sommaire exposant toutes les tentatives de synthèse de nucléosides 2’‑C‑Me/F. Après avoir traité des recherches documentaires et des tentatives relatives aux approches du nucléoside et du cycle glucidique, il conclut que [traduction] : « toutes les stratégies mises à l’essai pour introduire un groupe méthyle en position 2’ (haut) et un atome de fluor en position 2’ (bas) ont échoué ». M. Griffon a envoyé ce rapport à l’équipe de chimistes d’Idenix à Cambridge, au Massachusetts.
2) M. Griffon remplissait‑il les critères d’une personne versée dans l’art?
[608] L’obstacle majeur en ce qui a trait au caractère suffisant de la divulgation habilitante d’Idenix tient au fait gênant que M. Griffon n’a pas réussi à fabriquer le composé 2’‑C‑Me/F, alors qu’Idenix tente de prouver le contraire en avançant qu’il l’a fabriqué sans s’en apercevoir. Comme je l’ai déjà fait remarquer, si la Cour ne peut pas accepter les arguments d’Idenix mettant en cause la compétence de son propre employé, tout argument fondé sur les connaissances générales courantes et les essais courants par tâtonnement doit également échouer, compte tenu de ses tentatives infructueuses de synthèse du composé.
[609] La stratégie d’Idenix consiste donc à démontrer que M. Griffon a fabriqué le composé, ce qui confirmerait l’assertion suivant laquelle Jeremy Clark et lui ont tous deux réussi à établir qu’il n’était pas difficile de le faire, et à montrer en même temps qu’il était incompétent, pour prouver apparemment que même les chimistes incompétents pouvaient fabriquer ce composé au moyen d’expériences suffisantes. L’autre observation suivant laquelle M. Griffon a dissimulé son incompétence à ses supérieurs et collègues chimistes de l’équipe des découvertes chimiques chez Idenix en déformant ses résultats vient compléter cet argument.
[610] Idenix a avancé un certain nombre d’allégations contre M. Griffon afin de démontrer qu’il n’était pas un chimiste versé dans l’art; je les tire ci‑dessous de ses observations écrites :
[traduction]
[447] Bien que les compétences de M. Griffon atteignent le niveau de la personne versée dans l’art (d’après la Cour, elle les dépasse), ses travaux ou sa conduite ne sont pas conformes à ce qui est attendu d’une telle personne. En particulier, M. Griffon :
a) a effectué une recherche documentaire incomplète, ce qui l’a poussé dans une direction sous‑optimale;
b) n’a pas suivi les deux résultats les plus pertinents de sa recherche documentaire;
c) régulièrement, ne s’est pas soucié d’analyser les produits d’une réaction;
d) n’a pas respecté les conditions expérimentales décrites dans les antériorités sur lesquelles il a tenté de s’appuyer;
e) n’a pas suivi les instructions explicites de MM. Coe et Fleet et du cours sur la fluoration;
f) a tiré des conclusions inexactes et a dénaturé les résultats de ses expériences dans ses rapports d’étape mensuels;
g) n’a pas permis à ses superviseurs de lui offrir des conseils pertinents; ces derniers ne disposaient que de ses rapports d’étape inexacts, plutôt que de ses carnets de laboratoire, pour savoir ce que lui ou son assistante ou étudiante faisaient réellement;
h) avait une compréhension médiocre des principes fondamentaux de la chimie;
i) a manqué de jugement en permettant à des étudiants de premier cycle d’effectuer des réactions critiques.
[611] Je ne pense pas que toutes ces allégations soient entièrement pertinentes, ou du moins qu’elles appuient l’argument d’Idenix. Je prendrai donc la liberté de reformuler cet argument tel que je l’interprète au regard de ces allégations, avec quelques observations préliminaires lorsque je le juge approprié.
a) A effectué une recherche documentaire incomplète, notamment en ne suivant pas les résultats les plus pertinents que celle‑ci a produits, et en conséquence, n’a pas immédiatement adopté une stratégie de synthèse faisant appel au DAST (points a et b);
[612] M. Griffon s’est servi de l’outil de recherche usuel SciFinder pour passer en revue les publications scientifiques. M. Barrett déclare qu’il n’a trouvé aucune référence à des articles ou autres documents mentionnant le composé 2’‑C‑Me/F. Il a compris qu’il devait procéder à une nouvelle synthèse sans disposer du moindre article pour l’aider à fabriquer le composé cible.
[613] MM. Damha et Barrett soutiennent que M. Griffon a mal affiné sa recherche et a exclu des nucléosides ou des sucres en utilisant les groupes « CH 2 » au lieu de « C » ou de « CH ». Ils allèguent que M. Griffon aurait dû savoir que le composé cible ne présente pas de telles caractéristiques structurales et que, de ce fait, il aurait exclu un grand nombre de références utiles. Ils n’ont toutefois pas donné de références particulièrement importantes qui auraient été négligées par suite de l’affinement de sa recherche. Je ne crois pas que cette critique ait un effet sur la décision de M. Griffon de ne pas entreprendre sa synthèse avec le réactif DAST.
[614] Je suis également troublé par le fait que M. Griffon ne semble pas avoir eu la possibilité de s’expliquer sur son échec allégué. Idenix a simplement confirmé la nature de ses recherches. Il aurait dû être informé des opinions de MM. Damha et Barrett, et invité à dire s’il souscrivait à leurs critiques et si celles‑ci avaient fait une différence dans l’issue de ses travaux.
[615] De plus, M. Griffon ne se rappelait plus s’il avait abordé ce sujet avec ses supérieurs, étant donné que plus de dix ans s’étaient écoulés depuis ces faits. Ses recherches étaient décrites dans ses rapports et dans au moins une présentation. Ce n’est qu’une des questions, parmi d’autres, à l’égard desquelles ses supérieurs auraient dû intervenir s’ils n’étaient pas satisfaits de son travail en 2002.
[616] M. Griffon s’est également vu reprocher ne pas avoir tenu compte des deux résultats les plus pertinents de sa recherche documentaire. Il a avoué qu’il n’avait pas vu la référence dans l’article d’Olah au sujet de la fluoration d’un alcool tertiaire, mais cela n’a rien à voir avec l’utilisation du réactif DAST, puisque cet article traite de la réaction du pyridine‑HF avec un alcool tertiaire. Aucun des experts ne s’est exprimé là‑dessus.
[617] Le rapport relatif aux résultats de sa recherche contient plus de douze pages d’articles et de documents divers. Cela pourrait expliquer d’une certaine manière qu’il n’ait pas tenu compte d’un article apparemment sans pertinence.
[618] M. Griffon a également été critiqué pour ne pas avoir suivi l’article de Van Robays susmentionné, pourtant relevé dans sa recherche, dans lequel les auteurs décrivent la conversion réussie d’un alcool tertiaire en un fluorure tertiaire avec inversion stéréochimique à l’aide du DAST. M. Wnuk a fait observer que, dans la liste des expériences décrites dans ce document, souvent le produit principal était un réarrangement, et non le produit fluoré désiré. Cela va dans le sens de l’opinion exprimée par M. Coe selon laquelle les réactions avec fluor sont [traduction] « compliquées ».
[619] De plus, j’ai déjà fait remarquer que le produit de départ utilisé dans cet article est d’une structure très différente. M. Wnuk voyait une distinction importante dans le fait que l’article ne porte ni sur un nucléoside ni sur un ribose. Je souscris à son témoignage selon lequel l’article de Van Robays décrivait la substitution réussie d’un alcool tertiaire par un fluor dans une structure qui ne posait aucune des difficultés stéréochimiques d’un nucléoside ou d’un ribose. J’estime aussi que l’article ne pouvait pas représenter les connaissances générales courantes ni être d’un poids suffisant pour amener M. Griffon à employer le DAST comme réactif pour synthétiser le composé cible.
[620] Ajoutons que M. Griffon a affirmé dans son témoignage que ses propres travaux indiquaient que le rendement du DAST était très faible, raison de son utilisation du Deoxo‑Fluor® à la place. Cette conclusion paraît juste si l’on considère les rendements dans les expériences de M. Clark. Idenix a aussi laissé entendre que M. Griffon aurait dû employer le DAST au lieu du Deoxo‑Fluor® dans ses expériences. J’accepte la preuve selon laquelle le Deoxo‑Fluor® est un substitut du DAST et l’opinion de M. Griffon que ce produit était considéré à l’époque comme plus stable et plus sûr et, dans certains cas, plus puissant que le DAST. De toute manière, Idenix fait valoir aujourd’hui que M. Griffon a réussi à synthétiser le composé 2’‑C‑Me/F à l’aide du Deoxo‑Fluor®, ce qui clôt l’argument.
[621] À cet égard, je rejette de même toute affirmation selon laquelle les publications dirigeaient la personne versée dans l’art vers l’approche du cycle glucidique au lieu de celle du nucléoside, comme M. Damha tente de le faire croire en citant l’article de Wachtmeister. Là encore, cette critique me paraît vaine si l’on considère qu’Idenix allègue que M. Griffon a réussi à fluorer le ribonucléoside, alors que Jeremy Clark aurait fabriqué le composé 2’‑C‑Me/F au moyen des deux approches.
[622] De plus, M. Griffon a décrit les problèmes techniques qu’il avait eus à Montpellier pour simplement se procurer les publications scientifiques trouvées grâce à ses recherches. Il a déclaré qu’une fois la série de recherches terminée, le rassemblement de toutes les publications avait pris beaucoup de temps parce qu’à l’époque, les chimistes d’Idenix avaient un accès limité aux documents en ligne. Les autres avaient le choix entre deux procédures fastidieuses : aller à la bibliothèque de l’Université pour photocopier en personne les documents, ou braver la bureaucratie et commander les articles par l’intermédiaire du département des bibliothèques de l’Université, ce qui demandait encore plus de temps
[623] J’ai déjà conclu que les connaissances générales courantes n’orientaient pas nécessairement vers le DAST ou le Deoxo‑Fluor®. Qui plus est, les superviseurs de M. Griffon et d’autres experts consultés ne s’opposaient pas aux recommandations de fluoration par les approches du nucléoside et du cycle glucidique. Je n’estime pas que la preuve des experts d’Idenix suffit à démontrer que M. Griffon n’a pas mené des recherches appropriées ou l’incitait autrement à commencer sa synthèse par un réactif de fluoration nucléophile.
[624] Je prends aussi acte de la vaste expérience de M. Griffon dans l’utilisation de différents agents fluorants, dont le DAST pour la fluoration d’un alcool secondaire en position 2’ ou 3’ avec protection des autres hydroxyles par un groupe benzoyle. Le sujet de sa thèse était l’introduction d’un fluor en position 2’ ou 3’ des nucléosides. Il possédait une expérience et des connaissances bien plus vastes de la fluoration des nucléosides que le chimiste versé dans l’art. On pouvait s’attendre à ce qu’il s’appuie sur ses propres recherches et sa propre expérience, particulièrement dans un domaine où, comme l’a déclaré M. Wnuk, il n’existait généralement guère d’expertise en 2002‑2003.
[625] Certains éléments de preuve démontrent que M. Griffon avait déjà discuté de ses travaux avec MM. Storer et Gosselin et sans doute aussi avec ses collègues chimistes d’Idenix. M. Fleet avait également été consulté et n’avait pas recommandé de voie de synthèse avec le DAST. Ces éléments de preuve confirment seulement qu’il n’existait pas de connaissances courantes qui auraient nécessairement amené M. Griffon à s’engager dans la voie du DAST. Ils confirment aussi qu’il tentait de synthétiser un composé nouveau sans guère de direction quant à la voie à suivre, d’où les efforts de plusieurs mois qu’il avait déployés avant d’amorcer ses expériences avec le Deoxo‑Fluor® en février 2003. À cette époque, il travaillait déjà depuis environ 10 mois sur les nucléosides 2’‑C‑Me/F. Il avait essayé un certain nombre de stratégies et d’agents de fluoration. Il n’a reçu les recommandations de M. Coe qu’en avril 2003 et nulle part ce dernier ne proposait la fluoration d’un alcool tertiaire d’un sucre à l’aide du DAST. Même si l’expérience de M. Griffon avec le Deoxo‑Fluor® en février 2003 avait réussi, ce succès ne serait survenu qu’après une période excessive d’expérimentation.
[626] Je rejette donc les observations d’Idenix selon lesquelles M. Griffon n’aurait pas suivi la démarche d’un chimiste versé dans l’art en ne commençant pas son projet de synthèse avec le DAST pour la fluoration du nucléoside 2’‑C‑OH/Me, et que sa recherche documentaire aurait joué un grand rôle dans le choix de ses voies de synthèse.
[627] Je me range aussi à l’avis de M. Wnuk, selon qui les voies choisies par M. Griffon étaient raisonnables dans les circonstances et le succès de l’invention du composé 2’‑C‑Me/F exigeait une expérimentation excessive.
b) Régulièrement, ne s’est pas soucié d’analyser les produits d’une réaction (point c); et a tiré des conclusions inexactes (point f)
[628] Idenix allègue que M. Griffon a réussi à synthétiser le composé 2’‑C‑Me/F quand il a opté pour la fluoration à l’aide du Deoxo‑Fluor®, mais que, à cause d’une analyse insuffisante des produits obtenus, il ne s’est pas rendu compte de sa réussite.
[629] M. Griffon a fait deux tentatives en février 2003 pour fabriquer le composé à l’aide du Deoxo‑Fluor®, soit le 13 et le 19 février 2003. Les parties ne semblent avoir formulé des observations que sur la première tentative. L’expérience comportait un certain nombre d’étapes, dont celle de la préparation ou de l’utilisation du composé intermédiaire 2’‑C‑OH/Me. Rien de son travail dans ces essais ne semble avoir fait l’objet de critiques.
[630] Idenix fait valoir que M. Griffon a commis une faute en n’analysant pas le produit de sa synthèse comme l’auraient fait des chimistes versés dans l’art de la découverte de médicaments pour déterminer tous les composés du mélange réactionnel. S’il l’avait fait, soutient Idenix, il se serait rendu compte qu’il avait synthétisé le composé 2’‑C‑Me/F. Idenix cite à l’appui de ses allégations le fait qu’AMRI a réussi en 2014 à synthétiser le composé lors d’une simulation des expériences de M. Griffon menées avec le Deoxo‑Fluor®.
[631] Je n’accepte pas ces arguments pour trois raisons. Premièrement, je conclus que M. Griffon a fait preuve d’une compétence adéquate en menant ses expériences et en décidant de ne pas analyser tous les mélanges réactionnels de son expérience avec le Deoxo‑Fluor®.
[632] Deuxièmement, je n’ai pas la conviction que les expériences menées avec le Deoxo‑Fluor® par M. Griffon ont vraiment permis de synthétiser le composé 2’‑C‑Me/F, comme le prétend Idenix.
[633] Troisièmement, M. Griffon était soumis à des restrictions dans son milieu de travail à l’Université de Montpellier, et j’estime que ce facteur a joué dans le fait qu’il n’ait pas recouru à la spectrométrie de masse ni à la RMN pour analyser le mélange réactionnel, qui, selon les allégations d’Idenix, contenait le composé cible.
(i) La décision de M. Griffon de ne pas caractériser un produit réactionnel à cause de son manque de « carbonisation »
[634] Après avoir mené à terme l’expérience avec le Deoxo‑Fluor®, M. Griffon a procédé à une analyse par CPLHP. Il a ainsi pu établir l’existence de six ou sept composés différents dans le mélange réactionnel. Il lui était impossible d’identifier les composés présents avec cette technologie. La détection des composés exigeait une analyse par un spectromètre de masse ou un appareil de RMN. Il est important de souligner que l’Université de Montpellier possédait de tels appareils. Elle avait imposé à Idenix des restrictions concernant l’analyse des composés synthétisés lors des expériences de ses chimistes.
[635] M. Griffon a purifié et séparé le mélange réactionnel brut par chromatographie sur colonne à gel de silice. Il a fini par combiner le produit séparé en trois fractions afin de concentrer les composés réactionnels. Il avait identifié les flacons de la séparation initiale et les a combinés pour produire des fractions. La fraction 1 de 27 mg se composait des flacons 5 à 7, la fraction 2 de 20 mg, des flacons 8 et 9 et la fraction 3 de 72 mg, des flacons 10 à 14 (produit de départ).
[636] M. Griffon a placé une goutte de chaque fraction au bas de la lame de CCM et a tiré un trait au‑dessus des trois taches comme ligne de départ. Il a placé la lame dans un solvant pour permettre aux produits de monter sur la lame selon les différences de solubilité, de polarité et d’absorption des composés. On peut déterminer la position des composés sur la plaque de CCM en exposant celle‑ci à la lumière ultraviolette.
[637] Par la suite, M. Griffon a coloré la lame à l’acide sulfurique, ce qui a rendu visibles les taches des composés. Ce type de coloration carbonise de préférence les glucides (sucres).
[638] Les taches contenant des sucres sont carbonisées et deviennent donc foncées au contact d’un colorant contenant de l’acide sulfurique. Les composés sans glucides (p. ex., une base à laquelle on n’a pas réussi à coupler un sucre,) ne prennent pas une teinte aussi foncée, alors que le nucléoside 2’‑C‑Me/F est un sucre qui serait carbonisé. La CCM ne permet pas de reconnaître les composés qui se forment, mais elle permet de savoir si une réaction a eu lieu et peut renseigner quelque peu sur la nature des produits réactionnels grâce à la carbonisation résultant de la coloration des taches glucidiques.
[639] On peut voir ci‑après la plaque de CCM finale de l’expérience avec le réactif Deoxo‑Fluor®. Il convient de noter que sa description est tirée des observations écrites d’Idenix avec sa légende explicative, ce dont il sera question plus amplement plus loin. Les composés contenus dans les trois fractions sont dans les pistes verticales, et les composés visibles sont encerclés au crayon.
[640] Les éléments de preuve révèlent que les composés des pistes de droite (produit de départ) et du milieu sont carbonisés, indice qu’il s’agit de glucides. Il n’y a aucun signe de carbonisation du composé de la piste de gauche.
[641] M. Griffon a admis qu’il lui était impossible d’identifier les composés des fractions obtenues lors de son expérience à l’aide de la plaque de CCM finale. Pour ce faire, il aurait fallu qu’il analyse les fractions réactionnelles par spectrométrie de masse ou RMN.
[642] Dans ses observations, Idenix mentionne que la piste de gauche non carbonisée contient le produit que, selon elle, le chimiste versé dans l’art aurait analysé par spectrométrie de masse ou RMN. M. Griffon a identifié le produit de la fraction 2 dans la piste du milieu comme étant un glucide et peut‑être un ribonucléoside. Ce produit a été analysé à l’aide des appareils de spectrométrie de masse et de RMN de l’Université de Montpellier sans qu’y soit décelé le composé cible.
[643] La piste de droite, qui était apparemment un mélange glucidique parce qu’elle était carbonisée, n’a pas été analysée. M. Griffon a supposé que c’était le produit de départ. Ce point ne semble pas avoir été contesté.
[644] On a demandé à M. Griffon pourquoi il n’avait pas analysé tous les composés par spectrométrie de masse et RMN. Voici ses explications :
[traduction]
Q. Maintenant, dites‑nous pourquoi, si vous aviez les trois fractions séparées, vous ne les avez pas analysées par spectrométrie de masse ou RMN?
R. Parce que, voyez‑vous, parce que, dans ce cas, j’ai supposé que c’était le produit de départ, à en juger par la CCM.
LE JUGE ANNIS : J’ai besoin de votre aide ici : avez‑vous marqué quelque chose à l’écran?
LE TÉMOIN : Celui-ci.
LE JUGE ANNIS : Celui du bas, oui, n’est‑ce pas?
LE TÉMOIN : Celui-ci a été identifié.
LE JUGE ANNIS : Vous avez pensé que c’était le produit de départ, celui de la piste de droite?
LE TÉMOIN : Oui, oui.
LE JUGE ANNIS : Très bien.
LE TÉMOIN : Et cet autre.
LE JUGE ANNIS : Vous regardez maintenant celui de la piste de gauche?
LE TÉMOIN : Oui, j’ai supposé que c’était la base seule sans le sucre. Et c’est parce qu’il n’était pas carbonisé, il n’y avait définitivement pas de sucre fixé à cette base.
[Non souligné dans l’original.]
[645] Le témoignage de M. Griffon m’apparaît clair à ce sujet. Il a conclu que le nucléoside cible 2’‑C‑Me/F n’était pas le produit de la piste de gauche dans son expérience. Qu’il dise [traduction] « il n’y avait définitivement pas de sucre fixé à cette base » est l’expression d’une opinion ferme : il n’y avait pas de carbonisation et il ne s’agissait donc pas d’un glucide, d’où l’impossibilité qu’il s’agisse d’un nucléoside 2’‑C‑Me/F.
[646] M. Wnuk a convenu que c’était là une supposition raisonnable de la part de M. Griffon. Les parties pertinentes de son opinion figurent au paragraphe 15 de son affidavit en réplique :
[traduction]
[…] À mon avis, c’étaient là des suppositions raisonnables de la part de M. Griffon. En particulier, il aurait été raisonnable de supposer que les fractions 5 à 7 contenaient la base uracile, puisque la tache de CCM correspondante n’est pas carbonisée et n’est donc pas foncée.
[…] Les taches contenant des sucres devraient être carbonisées et devenir foncées après une coloration à l’acide sulfurique. Comme les taches correspondant aux fractions 5 à 7 ne semblent pas très foncées, on peut en déduire qu’il n’y a pas de sucre présent en grande quantité dans ces taches.
[647] L’avocat d’Idenix n’a pas voulu pousser la discussion sur la supposition de M. Griffon selon laquelle le produit de la troisième piste ne contenant pas de nucléoside, à en juger par l’analyse comparative de la carbonisation. Il faut reconnaître que, M. Griffon ayant été appelé à témoigner pour Idenix, des objections auraient été possibles s’il avait poursuivi son témoignage. Il reste que la question de la carbonisation des glucides n’a été abordée dans aucun des rapports ou témoignages d’experts d’Idenix et que M. Wnuk n’a pas été contre‑interrogé là‑dessus. À noter que la question a aussi été soulevée dans la décision Sovaldi au Royaume‑Uni, et Idenix n’a donc pas été surprise par le témoignage de M. Griffon.
[648] Idenix paraît plutôt avoir adopté une stratégie nouvelle dans ses observations finales. Elle fait une distinction entre les deux composés encerclés dans la piste de gauche. Pour la première fois à la connaissance de la Cour, Idenix prétend que M. Griffon aurait dû analyser la ou les taches supérieures issues du mélange de la fraction 1 dans la piste de gauche.
[649] Autant que la Cour puisse en juger, les références antérieures dans la présente affaire, et dans l’affaire entendue au Royaume‑Uni, ne font état d’aucune distinction entre les taches de la piste de gauche. Les composés de la piste de gauche ont plutôt été considérés globalement pour juger du caractère raisonnable de la supposition de M. Griffon quant à l’absence de signes de carbonisation dans le mélange réactionnel.
[650] Il semblerait toutefois, à voir les légendes illustrées plus haut sur la lame d’Idenix, que cette société déclare dans ses observations écrites finales présentées après les plaidoiries que le plus petit composé du haut qui est encerclé aurait dû être analysé plus avant par spectrométrie de masse ou RMN. Idenix décrit cette tache supérieure comme [traduction] « non analysée » et renvoie au témoignage de M. Wnuk qui l’appelle [traduction] « un autre produit ».
[651] Je ne crois pas que lorsqu’il parlait d’un autre produit dans la piste de gauche M. Wnuk établissait une distinction entre la grande tache du bas et la petite tache du haut.
[652] Ce témoignage a été donné à la suite de questions de la Cour, qui désirait mieux comprendre les observations de M. Wnuk, compte tenu surtout de mon inexpérience dans le domaine de la chromatographie sur couche mince.
[traduction]
LE JUGE ANNIS : Il a donc analysé la fraction 8‑9, celle du milieu?
Me MARKWELL : Oui.
M. LE JUGE ANNIS : Très bien.
PAR Me MARKWELL :
Q. Croyez‑vous qu’un chimiste versé dans l’art estimerait que c’était une décision raisonnable?
R. Oui.
Q. Êtes‑vous en mesure de déterminer ce qu’a obtenu M. Griffon?
R. Je pense dans son rapport –
M. LE JUGE ANNIS : Pouvez‑vous expliquer pourquoi la décision était raisonnable?
Me MARKWELL : Certainement.
PAR Me MARKWELL :
Q. Vous en êtes venu à la conclusion que M. Griffon – un chimiste versé dans l’art aurait estimé que ce que M. Griffon avait décidé d’analyser était raisonnable; pourquoi dites‑vous cela?
R. Parce qu’à l’analyse de [la] polarité du composé, le groupe hydroxyle a été échangé – si la réaction avait réussi, il y aurait eu échange avec le fluor. Le produit serait donc moins polaire et aurait monté plus haut sur la CCM que le produit de départ.
LE JUGE ANNIS : Qu’entendez‑vous par « plus haut »? Sur la lame?
LE TÉMOIN : Ce serait la tache du milieu.
[653] M. Wnuk faisait allusion aux deux grandes taches carbonisées des pistes du milieu et de droite lorsqu’il parlait de la décision qu’a prise M. Griffon d’analyser les composés de la piste du milieu et pas ceux de la piste de gauche. La carbonisation indiquait qu’il s’agissait de glucides de nucléoside dans les deux cas. Cependant, le déplacement plus grand dans la piste du milieu que dans celle de droite indiquait que le fluor avait remplacé l’hydroxyle, ce pour quoi le composé dans la piste du milieu se situait au‑dessus du composé de la piste de droite sur la plaque de CCM.
[654] M. Wnuk ne parlait pas de la piste de gauche quand il traitait de la question. Il avait déjà convenu avec M. Griffon qu’il était improbable que cette piste contienne le glucide fluoré parce qu’elle n’était pas carbonisée.
[655] Dans ses observations finales, évoquées brièvement dans le texte qui concerne le composé du haut dans la piste de gauche de la plaque de CCM déjà présentée, Idenix fait maintenant valoir que cette plus haute position dans la piste de gauche signifie que la tache ne pouvait pas être une base sans fluor, car elle aurait été plus bas sur la lame de CCM.
[656] M. Barrett a témoigné après M. Griffon. Il n’a pas traité de la supposition de M. Griffon quant à l’absence de carbonisation de la fraction de la piste de gauche. En fait, même quand il a abordé la question de la polarité et de son incidence sur le déplacement de la tache contenant la base uracile dans ses commentaires sur la plaque de CCM illustrée plus haut, il n’a distingué aucune des taches de la piste de gauche en indiquant que la plus haute serait probablement celle qui contient le composé 2’‑C‑Me/F. Il a seulement dit que [traduction] « Elle ne monte pas très haut, elle ne va pas jusqu’en haut de la plaque. Elle reste plus ou moins dans le bas ».
[657] Vu la preuve dont était saisie la Cour au moment où a témoigné M. Barrett, je conclus qu’il n’était pas prêt à admettre que la tache supérieure contenait probablement le composé 2’‑C‑Me/F. Comme il n’a pas contesté non plus la théorie de la carbonisation, j’estime qu’on ne peut pas dire de son témoignage qu’il va à l’encontre de la supposition de M. Griffon selon laquelle le nucléoside 2’‑C‑Me/F avec sa base glucidique n’était pas présent dans la fraction 1.
[658] Cette observation semble être venue d’une autre question visant à éclairer la Cour en ce qui concerne le produit de la troisième piste :
[traduction]
Me MARKWELL : Pardonnez mon ignorance, mais quelle est cette tache dans la colonne de gauche?
R. Dans la colonne de gauche, c’est un autre produit.
Q. Non, non, non. Il y a trois colonnes sur la lame de CCM.
Me SMITH : Vous venez de lui donner la réponse.
Je ne connais pas la réponse; je ne pourrais répondre.
LE JUGE ANNIS : Il dit que c’est un autre produit, un autre composé, je suppose.
[659] Comme il a été mentionné, toute la discussion antérieure avait porté sur les grandes taches dans les pistes comparées. L’idée que la ou les petites taches supérieures dans la piste de gauche étaient la source de comparaison n’avait jamais été évoquée. Tous les composés de la piste de gauche avaient déjà été écartés à cause de l’absence de carbonisation.
[660] À mon avis, il revenait à Idenix de préciser qu’elle établissait une distinction entre les différentes taches de composés encerclées dans la piste de gauche dans sa preuve présentée par M. Griffon ou ses experts. Elle était consciente de la controverse entourant la question de la carbonisation sur la plaque de CCM à la suite d’instances dans d’autres pays.
[661] Elle aurait également dû aborder avec M. Griffon la question de la polarité de la base et de sa position sur la plaque de CCM, de sorte que celui‑ci puisse répondre. Je n’attache donc aucun poids à cet élément de preuve. J’accepte la supposition de M. Griffon selon laquelle aucun composé cible n’a été synthétisé dans les expériences qui ont eu lieu le 13 février 2003.
[662] L’échec des tentatives de synthèse du composé cible 2’‑C‑Me/F ne saurait être imputé à M. Griffon. On le doit plutôt à un ensemble de variables telles que les solutions et les températures influant sur la fluoration d’un carbone tertiaire sur un ribonucléoside. Peut‑être est‑il attribuable au fait que les procédés de fluoration sont imprévisibles ou « compliqués », ainsi que l’affirme M. Coe dans sa lettre. Peut‑être un produit inadéquat a‑t‑il empêché la synthèse, comme cela s’est produit avec le réactif DAST qui aurait nui aux expériences effectuées par Pharmasset selon la description de M. Patterson. Faut‑il plutôt y voir le fait que, un certain jour et d’une manière inexplicable, une réaction n’ait pas fonctionné, comme l’a reconnu M. Damha?
[663] En tout état de cause, la preuve n’établit pas que le nucléoside 2’‑C‑Me/F a été synthétisé le 13 février 2003 ni qu’un manque de compétence de la part de M. Griffon a concouru à cet échec.
[664] Je conclus donc, d’après toute la preuve présentée, que M. Griffon a mené l’expérience de fluoration en chimiste versé dans l’art à l’aide du réactif Deoxo‑Fluor® et est parvenu à la conclusion raisonnable que le nucléoside 2’‑C‑Me/F n’avait pas été synthétisé dans le produit obtenu.
(ii) Les exigences pour caractériser tous les produits d’une réaction en 2003
[665] Je ne souscris pas non plus au témoignage de M. Damha lorsqu’il a dit à propos des plaques de CCM obtenues par AMRI que [traduction] : « en voyant ces plaques de CCM, la personne versée dans l’art aurait purifié et caractérisé les produits qui s’étaient formés au cours de la réaction. » Je me range à l’avis plus réaliste de M. Wnuk selon lequel la personne versée dans l’art n’aurait pas purifié et caractérisé tous les produits en 2003. Il a été signalé que les plaques de CCM d’AMRI et de M. Griffon montrent que des produits multiples ont été observés. Dans certains cas, au moins 10 taches sont observées sur une plaque. Par ailleurs, un certain nombre de taches sont plus polaires que le produit de départ, ce qui laisse croire que des groupes protecteurs ont été perdus dans le produit de départ ou encore dans les produits ou sous‑produits de la réaction.
[666] J’admets que la personne versée dans l’art n’aurait pas purifié et caractérisé tous les produits d’une telle réaction, ni même peut-être un seul. Plus précisément, vu les efforts manuels à déployer pour purifier des produits par chromatographie sur gel de silice, c’eût été un manque d’efficacité pour M. Griffon de purifier et de caractériser chaque produit formé dans des réactions ayant donné 7 à 10 composés. J’admets aussi que la technologie de purification plus avancée que constitue la CPLHP n’était pas d’usage courant comme première méthode de purification de chaque réaction en laboratoire vu ses coûts et sa complexité indue. La personne versée dans l’art aurait probablement recouru à la chromatographie sur colonne à gel de silice pour purifier le mélange réactionnel brut.
[667] De toute manière, la Cour a toujours compris que c’était la grande tache de la piste de gauche qui, selon les allégations d’Idenix, aurait dû être caractérisée. M. Griffon était parvenu à la conclusion qu’il ne s’agissait pas d’un sucre parce qu’il n’y avait pas eu de carbonisation.
(iii) Les restrictions imposées par Montpellier à l’égard des analyses
[668] Je formulerai aussi des observations sur le témoignage de M. Griffon selon lequel il aurait été soumis à des restrictions parce que les protocoles de l’Université de Montpellier exigeaient que les échantillons issus des réactions présentent un certain degré de pureté et de rendement pour être caractérisés par ses appareils de spectrométrie de masse et de RMN.
[669] Quand cette question a d’abord été soulevée par M. Griffon, celui‑ci a déclaré que la démarche normale imposée par l’Université était de ne soumettre à la RMN et à la spectrométrie de masse que des composés purs, ce par quoi il entendait des composés purifiés par chromatographie sur gel de silice.
[670] Par la suite, quand l’avocat d’Idenix a voulu obtenir plus de précisions sur cette réponse, M. Griffon a réaffirmé qu’il avait l’obligation de fournir des [traduction] « composés purs ». Il a ajouté que, pour analyser du fluor par RMN, il devait disposer de [traduction] « plus de 12 milligrammes [de produit] à l’état pur ». Dans le cas de la spectrométrie de masse, il a déclaré qu’un seul milligramme était requis. Il n’a donné aucune précision sur le degré de pureté requis pour répondre aux normes universitaires, et personne ne l’a interrogé là‑dessus.
[671] La Cour ne dispose que de peu d’information sur les raisons de ces restrictions et de peu de détails concernant la façon dont leur application a empêché l’analyse du mélange illustré par les taches de la piste de gauche de la plaque de CCM. M. Griffon a cependant évoqué deux fois dans son témoignage les restrictions comme facteur ayant empêché une analyse de suivi par spectrométrie de masse ou RMN. S’ajoute à ce facteur sa conviction que le produit non analysé n’était pas un sucre parce qu’il n’était pas carbonisé.
[672] Idenix dit ne pas savoir au juste pourquoi les restrictions étaient imposées par l’Université. Elle fait aussi valoir avec une logique évidente que, s’il était incapable de mener ces expériences par SM et RMN, M. Griffon se trouvait à ne pas avoir accès aux instruments analytiques de base que la personne versée dans l’art aurait dû avoir à sa disposition.
[673] C’est peut‑être le cas, cependant cet élément de preuve relevait entièrement du contrôle et de la connaissance d’Idenix et de ses témoins qui travaillaient en collaboration avec l’Université. Il provenait de la bouche même de M. Griffon, un employé d’Idenix appelé à témoigner pour son compte. D’autres témoins auraient dû être au fait de ces restrictions. M. Gosselin enseignait à Montpellier, et d’autres employés d’Idenix étaient tenus de suivre le même protocole. Dans les circonstances, en l’absence d’éléments de preuve contradictoires, et ayant conclu que M. Griffon était un témoin crédible, je reconnais qu’il travaillait dans des conditions d’accès limité aux appareils de Montpellier servant à la caractérisation des composés. Ces problèmes étaient ceux d’Idenix et ne relevaient pas de la responsabilité de M. Griffon.
c) M. Griffon a dénaturé les résultats de ses travaux et n’a pas permis à ses superviseurs de lui offrir des conseils pertinents (point f)
[674] Avant d’entrer dans les détails d’une critique de fausse présentation, ou des autres allégations d’incompétence avancées contre M. Griffon, je souligne que les superviseurs de ce dernier étaient les mieux placés pour prouver ces allégations. M. Griffon était sous la supervision de MM. Gosselin et Storer durant cette période. Ils sont eux-mêmes des chimistes très compétents et estimés. Il n’est pas nécessaire de se tourner vers MM. Barrett et Damha pour critiquer M. Griffon. La Cour privilégiera ceux qui ont pris part aux événements en cause et qui sont en mesure de décrire les faits et de se prononcer sur les échecs de M. Griffon. En l’absence de leur témoignage, je ne vois pas bien comment la Cour pourrait tirer des conclusions défavorables à M. Griffon concernant les allégations suivantes :
- M. Griffon avait effectué à leur insu une recherche documentaire incomplète;
- il effectuait son travail sans se rapporter à eux et sans leurs directives; ils ont été induits en erreur par les rapports et les conclusions de M. Griffon;
- son défaut d’analyser tous les composés réactionnels, plus particulièrement ceux issus des expériences avec Deoxy‑Fluor, n’était pas pratique courante à Montpellier et avait joué un grand rôle dans l’échec d’Idenix quant à la synthèse du composé;
- M. Griffon a affecté son assistante de recherche aux expériences avec le DAST dans ce que M. Barrett jugeait être des circonstances dangereuses;
- d’une manière générale, M. Griffon ne comprenait pas les principes fondamentaux de la chimie.
[675] J’admets aussi que je suis préoccupé par le traitement qu’Idenix a réservé à M. Griffon, qui est encore un de ses employés. Il est pourtant clair qu’il a été appelé à témoigner quant à sa propre incompétence. J’estime que c’est une position intolérable dans laquelle mettre un employé. D’après mon évaluation, M. Griffon s’est présenté devant la Cour dans l’intention d’aider son employeur, pour autant qu’il n’ait pas à dire de mensonges, ce qu’à mon avis il n’a pas fait.
[676] J’ai toutefois du mal à croire qu’il ait accepté de subir une attaque en règle contre sa compétence professionnelle en laissant son employeur, les avocats de celui‑ci et des témoins experts très estimés avancer des allégations préjudiciables du type de celles évoquées plus haut. Je ne pense pas qu’il aurait accepté que quelqu’un de la stature de M. Barrett déclare que son incompétence avérée était telle qu’il n’aurait pas tenu deux semaines à son emploi. Il me paraît également improbable qu’il ait collaboré avec les avocats d’Idenix, s’il savait qu’il se ferait appeler « Griffon » d’un bout à l’autre des observations, alors que tous les autres titulaires de doctorats ayant pris part à l’affaire se sont vus désignés par leur titre durement acquis.
[677] Mais sans égard à l’injustice apparente avec laquelle M. Griffon a été traité, j’insiste sur ma conclusion de fond portant qu’en l’absence du témoignage de ses superviseurs, il n’existe aucun fondement probatoire à la plupart des allégations avancées contre lui. Seuls ses superviseurs peuvent fournir le fondement factuel sur lequel la plupart des avis d’expert reposent. J’estime qu’il est raisonnable de présumer que les superviseurs de M. Griffon n’étaient pas prêts à témoigner contre un employé de longue date, apparemment compétent, et qu’ils ne blâment pas pour l’échec d’Idenix à synthétiser le composé 2’‑C‑Me/F.
[678] Malgré les faiblesses de la preuve avancée contre M. Griffon, je répondrai néanmoins aux principales critiques formulées contre lui, d’autant plus que j’ai conclu qu’elles sont infondées ou sans pertinence au regard des questions dont je suis saisi.
[679] La preuve concernant la fausse déclaration alléguée de M. Griffon est la suivante :
[traduction]
Q. Et voyez‑vous la quatrième ligne à partir du bas des paragraphes en bas?
R. Oui.
Q. Un nouveau composé s’est formé pendant la réaction?
R. Oui.
Q. Si nous regardions la CPLHP ou les fractions que vous avez séparées?
R. Oui.
Q. Votre rapport n’a pas l’air de concorder?
R. Oui. Non. Non, il ne concorde pas.
Q. Pourquoi avez‑vous – avez‑vous jamais dit à M. Gosselin ou M. Storer que vous aviez réellement obtenu plus d’un composé durant cette période?
R. Non.
Q. Pourquoi pas?
R. Parce que c’était un résumé, et je voulais [suis allé] jusqu’au bout de ma conclusion, et ma conclusion était que le composé principal, le seul composé comme produit principal formé était le – n’était pas le composé cible.
Q. Et ça ne concorde pas avec les résultats de votre expérience, n’est‑ce pas?
R. Non, ça ne concorde pas.
[680] Voilà ce que je décrirais comme un exemple où M. Griffon a suivi son employeur en ne se hasardant à fournir aucune explication réelle sur ce qui s’est produit.
[681] Premièrement, il appert de la preuve précitée que M. Griffon a conclu que le seul composé qui aurait pu être le composé cible, c’est‑à‑dire la piste du milieu, ne l’était pas. Il n’avait pas à préciser que les autres composés avaient été éliminés parce qu’ils n’étaient pas carbonisés.
[682] Deuxièmement, à voir les commentaires de MM. Damha et Barrett concernant les 7 à 10 composés décrits dans les imprimés de CPLHP et ceux des expériences d’AMRI, il paraît évident que ses superviseurs se seraient attendus à ce que plus d’un composé se forme dans un mélange réactionnel à la suite de la fluoration d’un nucléoside. Il est difficile de croire que ses superviseurs et les autres membres de l’équipe de découverte de médicaments, avec qui M. Griffon a discuté de son travail selon la preuve, auraient ignoré que bien des produits secondaires seraient issus de ses expériences. Un facteur qui joue dans cette conclusion est que la plainte d’Idenix vise non plus la grande tache non carbonisée dans la piste de gauche, mais les plus petites au‑dessus.
[683] Troisièmement, M. Griffon a déclaré que seuls les mélanges réactionnels purifiés à plus grand rendement pouvaient être présentés au Département de chimie de l’Université de Montpellier où apparemment Idenix devait, comme les étudiants et tous les autres, remplir des formulaires et attendre un certain nombre de jours pour recevoir les résultats de son analyse. Il est difficile de croire que ses superviseurs et ses collègues n’auraient pas été au courant de ces restrictions opérationnelles limitant le nombre de composés qui seraient analysés dans une réaction.
[684] Quatrièmement, M. Griffon a déclaré, comme il fallait s’y attendre, qu’il ne se souvenait pas des événements de 2003. Il ne se rappelait pas s’il avait eu ou non des discussions avec ses superviseurs et d’autres chimistes sur l’expérience avec le Deoxo‑Fluor®. Il est injuste envers M. Griffon de soulever une question telle que celle‑ci dix ans après, alors que sa capacité de répondre est limitée.
[685] Enfin, M. Griffon n’a ni motif ni raison d’induire en erreur ses superviseurs. Ses carnets démontrent qu’il était un chimiste méticuleux. Il est également manifeste qu’il se consacrait à la synthèse du composé cible. Rien ne permet de conclure qu’il aurait exclu des informations qui n’étaient pas considérées comme des informations devant être communiquées à des collègues avec qui il avait collaboré étroitement pendant plusieurs années.
[686] Je ne pense pas qu’Idenix a établi que M. Griffon a dénaturé ses résultats en excluant des informations que ses superviseurs s’attendaient à recevoir, ou qu’ils ont été induits en erreur par ses rapports, d’autant plus qu’ils n’ont pas témoigné.
d) n’a pas respecté les conditions expérimentales décrites dans les antériorités sur lesquelles il a tenté de s’appuyer (point d); n’a pas suivi les instructions explicites de MM. Coe et Fleet et du cours sur la fluoration (point e); avait une compréhension médiocre des principes fondamentaux de la chimie (point h); a manqué de jugement en permettant à des étudiants de premier cycle d’effectuer des réactions critiques (point i)
[687] Je ne tiens pas à répondre aux autres tentatives d’Idenix visant à démolir la réputation professionnelle de son propre employé, sinon pour faire remarquer très succinctement que M. Griffon n’a pas suivi les conseils de M. Fleet ou de M. Coe.
[688] Je ne suis pas au courant d’un conseil quelconque qu’aurait donné M. Fleet à M. Griffon. J’ai déjà signalé que, en fait, M. Coe n’avait pas recommandé le DAST dans les schémas proposés; il ne l’avait mentionné qu’en passant dans un énoncé général en introduction comme un exemple illustrant sa recommandation d’adopter l’approche du cycle glucidique par opposition à l’approche du nucléoside pour le produit de départ. Cette critique se révèle vaine, mais, de toute manière, M. Griffon a donné des raisons valables pour avoir préféré le Deoxo‑Fluor® au DAST, notamment en invoquant sa propre expérience pratique avec ces deux produits.
[689] En conclusion, en ce qui concerne les allégations avancées contre M. Griffon, j’estime qu’il n’a pas été établi qu’il ne s’est pas conduit comme un chimiste versé dans l’art dans les aspects suivants :
- en effectuant ses recherches et en tirant des conclusions de celles-ci;
- en n’adoptant pas immédiatement une voie de synthèse avec le DAST ou le Deoxo‑Fluor®;
- en purifiant et en caractérisant les résultats de ses expériences;
- en fournissant des informations à ses superviseurs concernant les résultats de ses recherches et expériences;
- en essayant de synthétiser le composé 2’‑C‑Me/F, tentatives dont l’insuccès serait le plus probablement imputable selon moi à des facteurs sans lien avec quelque manque de compétence que ce soit de sa part.
[690] Je conclus également que, si M. Griffon avait synthétisé le composé 2’‑C‑Me/F en février 2003, les recherches et expériences requises pour ce faire posaient trop de difficultés.
F. Les expériences d’AMRI
[691] L’autre volet de la stratégie suivie par Idenix pour démontrer que M. Griffon avait réussi à synthétiser le composé 2’‑C‑Me/F repose sur les simulations de son expérience du 13 février 2003 réalisées par AMRI en 2014. AMRI a réussi à synthétiser des composés 2’‑C‑Me/F dans ses deux séries d’expériences. Ces simulations visaient apparemment à étayer l’argument d’Idenix selon lequel la synthèse du composé avec un catalyseur DAST ou Deoxo‑Fluor® relevait des connaissances générales courantes.
[692] J’estime cependant que les expériences n’étaient pas des simulations fidèles de celles de M. Griffon. Je conclus qu’AMRI avait accès à une technologie lui permettant à la fois de synthétiser et de caractériser le composé 2’‑C‑Me/F avec plus d’aisance que M. Griffon en 2003. J’attache aussi moins de poids à ces essais, leur confidentialité selon les consignes d’Idenix étant source de préoccupations.
1) Les premiers essais menés en secret
[693] AMRI a simulé deux expériences de synthèse au moyen du Deoxo‑Fluor® que M. Griffon avait réalisées en février 2003. Gilead n’avait pas connaissance du premier essai effectué en juin 2014. Idenix a ensuite avisé Gilead de cette première expérience et l’a invitée à assister à la deuxième. Gilead a envoyé un représentant en observateur à l’expérience d’août 2014.
[694] Gilead a fait valoir à juste titre que la Cour devrait écarter les expériences de juin puisqu’elles avaient été menées en contravention de l’avis de la Cour fédérale aux parties et à la communauté juridique concernant les essais expérimentaux, bien qu’il ait été délivré le 27 novembre 2014. Comme j’estime qu’aucun des essais n’établit que M. Griffon a réussi à synthétiser le composé 2’‑C‑Me/F en février 2003, je ne vois aucune raison de rejeter le premier essai. Je m’appuie cependant sur le fait que celui‑ci a été effectué en secret pour accorder moins de poids au second.
2) Le défaut de consulter M. Griffon
[695] J’ai attribué moins de poids à ces expériences parce qu’Idenix n’a pas donné à M. Griffon la possibilité de les commenter. À mon avis, Idenix aurait dû obtenir l’avis de M. Griffon en général et, plus précisément, sur la question de savoir si les techniques employées par AMRI auraient donné à cette dernière de meilleurs moyens de synthétiser ou de caractériser les produits des essais menés par lui en 2003. Qui pouvait mieux que l’auteur des essais initiaux renseigner la Cour sur la fidélité des simulations d’AMRI par rapport aux expériences de 2003 pour ce qui est de la synthèse et de la caractérisation réussies du produit de ces essais?
3) Le défaut d’AMRI de simuler les essais de M. Griffon
[696] M. Wnuk a fourni une déposition que la Cour accepte et d’après laquelle les expériences menées par AMRI différaient sensiblement du protocole décrit dans le carnet de M. Griffon et des déclarations de témoins à deux égards importants et à d’autres égards peu importants et cumulatifs. Sa déposition est la suivante.
a) La surveillance différente de la réaction
(i) AMRI a employé des techniques de surveillance plus puissantes
[697] AMRI a utilisé la CPLHP couplée à la spectrométrie de masse, aussi appelée CPL‑SM. Je rejette l’explication d’Idenix selon laquelle l’utilisation de la CPL‑SM n’aurait eu aucune incidence sur l’identification ou non du produit cible dans le produit réactionnel par comparaison avec la situation en 2003. J’accepte le témoignage de M. Wnuk selon lequel cette technologie a permis à AMRI de repérer et de « repêcher » un produit réactionnel précis de masse donnée dans un mélange réactionnel complexe. Le scientifique d’AMRI pouvait alors s’attacher à un pic particulier du composé élué par CPLHP, purifier cette fraction un grand nombre de fois, puis la caractériser. Je reconnais toutefois qu’à première vue, d’après les éléments de preuve concernant les expériences, ces événements ne semblent pas s’être produits.
[698] M. Wnuk a toutefois fait remarquer que, pendant l’expérience 1 d’AMRI, un grand nombre de séries d’analyses ont été effectuées sur l’appareil de CPL‑SM d’AMRI pour établir des paramètres permettant de séparer adéquatement les composés présents dans le mélange réactionnel.
[699] M. Griffon n’a pas disposé de cette technologie avant 2006. Il se servait de la CCM, qui n’assure pas le même degré d’analyse et de caractérisation des fractions. Idenix ne contestait pas sérieusement ce témoignage. Je rejette donc l’explication d’Idenix selon laquelle l’utilisation de la CPL‑SM n’aurait en rien influé sur l’obtention ou non du produit cible.
(ii) Les techniques de purification différentes
[700] Idenix a utilisé la CPLHP en phase inverse, méthode de séparation et de purification des composés d’un mélange réactionnel brut. M. Griffon utilisait une colonne à gel de silice ordinaire. Les deux techniques servent à la séparation et à la purification, mais elles ne sont pas fonctionnellement équivalentes dans leurs limites de détection et la précision de la séparation qu’elles assurent. Le composé qu’a fabriqué AMRI était passablement pur. M. Damha pense qu’il l’était à plus de 90 %.
[701] M. Wnuk est d’avis que la CPLHP plus perfectionnée qu’a employée AMRI peut produire des résultats différents de ceux que l’on obtient par purification sur une colonne à gel de silice ordinaire. La CPLHP n’était pas une méthode de purification qu’aurait employée en 2003 le chimiste versé dans l’art. Jeremy Clark a utilisé la chromatographie sur colonne à gel de silice pour purifier le composé nucléosidique fluoré obtenu par fluoration avec le Deoxo‑Fluor® en 2003. Lors de la simulation, on aurait dû utiliser la même technologie si l’on voulait simuler fidèlement une pratique qui relevait des connaissances générales courantes en 2003. La chose revêt une importance plus grande si l’on considère qu’Idenix a tardivement allégué que le produit synthétisé par M. Griffon qui était présent dans la piste de gauche et qui devait être purifié était le produit mineur et non pas le produit principal.
[702] M. Wnuk conclut que la surveillance par CPLHP et CPL‑SM pourrait avoir permis d’isoler et d’identifier un composé désiré dans un mélange réactionnel complexe, alors que la chose aurait été impossible par chromatographie normale sur colonne à gel de silice et par CCM. Bref, AMRI a employé des techniques plus perfectionnées que celles auxquelles avait accès M. Griffon en 2003, ce qui pourrait avoir donné des résultats qui étaient hors de portée de la personne versée dans l’art avec la technologie disponible ou normalement utilisée en 2003.
(iii) Les différences mineures cumulatives
[703] M. Wnuk a résumé d’autres différences entre les protocoles figurant à la pièce « A » jointe à son rapport, et qu’il ne qualifierait pas de majeures. Il a néanmoins déclaré qu’il n’était pas possible de déterminer l’effet cumulatif des diverses modifications mineures du protocole sur les issues expérimentales. Il s’agit notamment de détails comme les suivants : verrerie de séchage et de dessiccation; réactifs et solvants provenant tous ou non de flacons ouverts; rinçage ou non des seringues utilisées pour distribuer la pyridine et le Deoxo‑Fluor; absence de thermocouple pour surveiller la température de réaction interne; et aucune indication concernant la question de savoir si la solution obtenue a été chauffée à reflux sous atmosphère d’argon.
b) L’utilisation différente des plaques de CCM
(i) AMRI n’a pas coloré les plaques à l’acide sulfurique
[704] M. Griffon a utilisé l’acide sulfurique pour colorer les plaques de CCM, alors qu’AMRI les a colorées à l’iode. L’acide sulfurique carbonise (colore) de préférence les glucides, c’est‑a‑dire les sucres. En comparaison, l’iode se lie de préférence aux doubles liaisons, mais sans effet de carbonisation.
[705] Idenix fait valoir que les différentes techniques d’observation ne font pas partie de la réaction et n’ont influé en rien sur le composé qui était fabriqué dans le mélange réactionnel. Ce n’est pas là la seule question. La question de savoir si le produit réactionnel contenait le nucléoside 2’‑C‑Me/F est moins pertinente à cet égard que celle de savoir si la technologie et les procédés employés par M. Griffon en 2003 relevaient des connaissances générales courantes et étaient suffisants pour permettre un premier criblage à partir d’un composé sans sucre. C’était là la raison pour laquelle il n’avait pas caractérisé le produit principal dans la troisième piste, point de mire des parties jusqu’à la fin des présentes.
[706] M. Griffon a utilisé la plaque de CCM comme moyen initial simplifié de criblage en s’appuyant sur ses années de travail avec les nucléosides pour éliminer un composé qui, visuellement, ne contenait pas de sucre. C’était là semble‑t‑il sa façon de faire habituelle. Idenix n’a pas présenté d’élément de preuve pour démontrer que ce n’était pas là une pratique généralement adoptée par ses chimistes ou les chimistes de synthèse en général en 2003 lorsqu’ils traitaient des produits isolés par chromatographie sur colonne à gel de silice. M. Griffon a conclu que le produit principal n’était pas un sucre après l’avoir comparé aux produits réactionnels carbonisés des deux autres pistes. Si AMRI avait utilisé l’acide sulfurique, il aurait pu y avoir comparaison directe pour établir si la conclusion de M. Griffon relativement à la carbonisation des sucres était exacte et pour comparer les résultats sur les deux plaques. Comme le produit était un nucléoside 2’‑C‑Me/F pur à 90 %, il aurait été intéressant pour la Cour de savoir si l’acide sulfurique l’aurait carbonisé. Idenix était consciente de l’importance de la question de la carbonisation dans la décision prise par M. Griffon de ne pas caractériser le produit de la troisième piste, surtout si l’on considère que cette question est liée aux allégations d’incompétence de M. Griffon.
(ii) Le rendement différent des composés
[707] De plus, les plaques de CCM préparées par AMRI ont été produites à des moments différents de la réaction par rapport à celles de M. Griffon. Outre la pureté du produit nucléosidique 2’‑C‑Me/F obtenu, ces plaques ne semblent pas compter le même nombre de taches. Dans le cas de la deuxième expérience d’AMRI, les plaques de CCM présentent des taches pouvant correspondre à un ou plusieurs composés. Selon M. Wnuk, le fait que l’expérience de M. Griffon et celles d’AMRI aient donné de multiples produits réactionnels différents empêche toute comparaison significative des plaques de CCM des diverses expériences.
c) L’élaboration en secret du protocole d’essai d’AMRI
[708] La raison pour laquelle AMRI n’a pas fidèlement suivi le protocole appliqué par M. Griffon n’a pas été expliquée. M. Clemens, le seul témoin à avoir fourni une preuve factuelle sur la conduite des expériences d’AMRI, a seulement déclaré qu’il avait reçu le protocole et été invité à le suivre, sans autre précision.
[709] De plus, il appert des documents qu’Idenix a divulgués au cours de l’instruction, et qui n’avaient pas été communiqués en vertu du secret professionnel de l’avocat, que M. Clemens était orienté par les avocats d’Idenix. Celle‑ci n’a pas expliqué pourquoi AMRI se laissait diriger par les avocats sur une question aussi technique. Il me semble qu’Idenix s’est servie des avocats pour garder secrètes les circonstances de l’élaboration du protocole sous le couvert du privilège relatif au litige. Comme Idenix n’a pas expliqué ces écarts de procédure, la Cour est disposée à inférer que le protocole de M. Griffon n’a pas été suivi pour améliorer les chances d’Idenix d’obtenir le résultat souhaité.
d) L’argument d’Idenix selon lequel Gilead aurait dû effectuer ses propres essais
[710] Idenix fait valoir en réplique que, si Gilead estimait que les protocoles suivis par AMRI ne reproduisaient pas fidèlement ceux adoptés par M. Griffon, elle aurait pu mener l’expérience pour prouver le contraire. Cet argument est au mieux facétieux et vise d’ailleurs à éluder les demandes d’explications de Gilead quant à la raison pour laquelle Idenix a effectué ses essais en secret en ne respectant pas, à d’importants égards, le protocole suivi par son propre employé, dont elle s’efforce de prouver l’incompétence.
[711] Les faits présents ne ressemblent en rien à ceux de l’affaire Abbvie Corporation c Janssen Inc, 2014 CF 55, citée par Idenix. Dans cette affaire, les essais se rapportaient à un produit appartenant à Janssen, laquelle, suivant le juge Roger Hughes, avait les moyens de le soumettre aux expériences nécessaires. En l’espèce, Idenix essaie de démontrer que les nouvelles expériences complexes en plusieurs étapes qu’a menées son employé il y a plus d’une décennie (lequel est toujours son employé) ont donné lieu à la synthèse d’un produit qu’elle a elle‑même synthétisé à l’aide d’outils plus perfectionnés après que les moyens d’une telle synthèse ont été rendus publics.
[712] J’estime que, si elle avait entrepris de reproduire les essais de M. Griffon, Gilead aurait eu à s’adresser à lui pour revoir dans le détail la manière dont il avait mené ses essais et les hypothèses qu’il avait adoptées à mesure que ceux‑ci progressaient. Les essais d’Idenix visaient tout autant à démontrer que M. Griffon ne remplissait pas les critères du chimiste versé dans l’art qu’à établir qu’il avait synthétisé le composé cible.
[713] Il n’y a aucune raison pour que Gilead assume les frais de ses propres essais alors qu’Idenix aurait pu fournir une meilleure solution simplement en étant plus transparente quant à ses propres procédures. Elle aurait dû proposer de faire appel à un organisme d’essais externe avec l’assentiment de Gilead. De même, elle aurait pu se montrer transparente en élaborant un protocole conforme à toutes les étapes suivies par M. Griffon et en autorisant Gilead à participer pleinement à tous les essais, le tout à ses frais. Dans les circonstances, même si Gilead avait rejeté ces offres, Idenix aurait pu soutenir de manière plausible que les résultats des essais méritaient une valeur probante considérable.
[714] Au lieu de cela, Idenix a élaboré le protocole d’essai en secret sous le couvert du privilège relatif au litige. Elle a effectué le premier essai en secret sans que Gilead ou la Cour ne sache qui avait mis au point le protocole ou comment il a pu être adapté en vue du résultat souhaité.
[715] Le premier essai a été suivi d’un second, et le secret a été maintenu sur les modalités d’élaboration du protocole d’essai. Là encore, Idenix n’a pas reproduit adéquatement la procédure de M. Griffon à d’importants égards, sans fournir d’explication rationnelle, ce qui permet à Gilead de soutenir qu’elle est arrivée au résultat souhaité à l’aide de techniques sophistiquées dont ne disposait pas M. Griffon.
[716] Dans les circonstances, Gilead n’avait aucune raison d’effectuer ses propres essais compte tenu des lacunes évidentes, multiples et importantes dans les expériences d’Idenix destinées à simuler celles de M. Griffon. Gilead n’avait rien à gagner à entreprendre des essais coûteux si elle était convaincue qu’Idenix ne pouvait pas raisonnablement convaincre la Cour que les essais d’AMRI permettaient de démontrer que la synthèse du nucléoside 2’‑C‑Me/F relevait des connaissances générales courantes et des essais courants en 2003.
[717] Pour tous les motifs qui précèdent, je conclus que les essais d’AMRI ont peu de valeur probante en l’espèce.
G. Les travaux des autres chimistes d’Idenix spécialisés dans la découverte de médicaments
1) L’admissibilité des transcriptions des déclarations de M. Stewart dans le cadre de l’instance britannique
[718] À la fin de l’instruction, Gilead a sollicité l’autorisation de déposer la déclaration de témoin de M. Stewart datée du 11 juillet 2014 (la déclaration de témoin) ainsi que la transcription d’un contre‑interrogatoire connexe effectué sous serment le 9 octobre 2014 (la transcription). Ces documents font partie du dossier de la précédente poursuite civile entre les deux parties devant la Haute Cour de justice britannique – Division de la chancellerie (Cour des brevets), demande no HP14D1069 (l’instance britannique); ils intéressent les mêmes questions qu’en l’espèce.
[719] M. Stewart a travaillé comme chimiste chez Idenix de septembre 2003 à décembre 2014 avant d’être congédié peu avant la présente instance pour des motifs inconnus.
[720] M. Stewart a travaillé chez Idenix à des projets de chimie médicinale. En mai 2004 ou vers ce mois, alors qu’il travaillait à l’établissement d’Idenix à Cambridge, au Massachusetts, M. Stewart a participé au projet de synthèse d’un nucléoside 2’‑C‑Me/F. Il a aussi eu beaucoup d’interactions avec un cabinet d’avocats en droit des brevets dans des litiges en matière de brevets et des procédures en revendication de priorité d’invention pour le compte d’Idenix. Son rôle était notamment d’apporter une perspective historique et des avis scientifiques.
[721] Autour de décembre 2004, Mme Wang, une autre chimiste de l’établissement de Cambridge, au Massachusetts, a également commencé à assister M. Stewart aux fins du projet.
[722] Aucun d’eux n’a témoigné. Idenix a demandé et obtenu le consentement de Gilead pour déposer la déclaration de témoin de Mme Wang, datée du 11 juillet 2014, ainsi que la transcription du contre‑interrogatoire connexe datée du 7 octobre 2014 et provenant de l’instance britannique.
[723] Cependant, Idenix n’a pas appelé M. Stewart à déposer à l’appui des arguments qu’elle a présentés en l’espèce. Par ailleurs, elle n’a pas consenti au dépôt de son témoignage sous serment présenté dans le cadre de l’instance britannique.
[724] L’authenticité ou l’exactitude des transcriptions ne fait pas débat. Le fait qu’elles ont été produites et effectuées sous serment en séance publique relativement au même contentieux concernant la synthèse du nucléoside 2’‑C‑Me/F et les mêmes parties ne fait que confirmer qu’elles sont fiables et dignes de foi.
[725] La crédibilité de M. Stewart n’est pas en cause, et la Cour n’est pas désavantagée par rapport au juge de l’instance britannique du fait de l’impossibilité d’observer le comportement du témoin. Tout avantage dont aurait bénéficié à cet égard le juge initial serait sans conséquence puisque la partialité sous‑entendue d’un employé appelé par Idenix serait rapportée à la défense de ses intérêts. À première vue, la transcription devrait conserver sa pleine valeur probante avec un bémol négligeable tenant à ce qu’elle n’a pas été fournie en présence de la Cour.
[726] Comme je l’ai déjà mentionné, M. Stewart a témoigné pour le compte d’Idenix dans l’instance britannique, il était un de ses employés.
[727] Au cours des débats à l’instruction, la Cour s’est dite d’avis que la déclaration et la transcription étaient admissibles à titre d’exception à la règle du ouï‑dire, dans la mesure où ces documents contenaient des aveux défavorables à l’intérêt d’une partie émanant d’un employé en position d’en faire : S. N. Lederman, A.W. Bryant et M.K. Fuerst, The Law of Evidence in Canada, 4e éd. (Toronto, Lexis‑Nexis Canada Inc, 2014), art. 6.453 (The Law of Evidence).
[728] Bien que les parties n’aient pas approfondi la question dans leurs observations, je persiste à penser que la déclaration de témoin et la transcription de M. Stewart sont admissibles par Gilead à titre d’exception à la règle du ouï‑dire, compte tenu de l’authenticité de leur contenu et parce que ces documents incluent des admissions d’Idenix venant d’un mandataire autorisé.
[729] Même si elles ne sont sans doute admissibles qu’en ce qui regarde les aveux contraires aux intérêts d’Idenix, compte tenu des exigences liées au contexte, j’admets la totalité de la déclaration de témoin et de la transcription.
[730] Dans ses observations, Gilead a cité certaines lois des États‑Unis et du Nouveau‑Brunswick autorisant l’admission d’un témoignage précédent dans une instance subséquente à titre d’exception à la règle du ouï‑dire (The Law of Evidence, aux art. 6.371 à 6.379). En vertu de cette exception, une partie peut produire le témoignage d’un témoin (par opposition à celui de la partie ou de son mandataire autorisé) se rapportant à une précédente affaire s’il a été appelé par la partie adverse sur la même question.
[731] Les parties ne s’entendaient pas sur la question de savoir si le témoignage est admissible en vertu de l’« analyse fondée sur des principes » des exceptions au ouï‑dire, s’il est établi qu’il est nécessaire et digne de foi : R c Starr, 2000 CSC 40. Leur différend ne porte que sur la question de la nécessité.
[732] Gilead fait valoir que la preuve émanant de M. Stewart est nécessaire, car, même s’il n’est plus un employé, il est encore soumis au contrôle d’Idenix. Gilead a produit une preuve par affidavit établissant que M. Stewart a informé son avocat qu’il avait des obligations permanentes envers Idenix en vertu d’une entente de licenciement. En l’apprenant, l’avocat de Gilead a mis fin à leurs échanges.
[733] Gilead soutient qu’elle n’est pas en position d’obtenir le témoignage de M. Stewart si Idenix exerce encore un certain contrôle sur lui, mais refuse de présenter la preuve de celui‑ci dans le cadre de l’interrogatoire principal.
[734] À ma connaissance, rien n’empêche une partie d’appeler des employés ou mandataires d’autres parties. Cela peut évidemment soulever des difficultés, mais qui se règlent d’elles‑mêmes lors du contre‑interrogatoire du même témoin. Si elle avait sollicité l’autorisation de la Cour, Gilead aurait néanmoins été autorisée à entreprendre des procédures visant à faire témoigner M. Stewart en l’espèce. Elle n’a pas non plus demandé à Idenix de le dégager des restrictions applicables l’empêchant de témoigner.
[735] Gilead n’a soumis aucun précédent à l’appui de son observation selon laquelle une partie ne peut pas appeler un employé de la partie adverse, à mon avis parce que le principe de nécessité ne s’applique pas en telles circonstances.
[736] Par conséquent, je conclus qu’il n’était pas nécessaire d’admettre en preuve la déclaration de témoin et la transcription des réponses de M. Stewart à titre d’exception à la règle du ouï‑dire fondée sur les principes de fiabilité et de nécessité.
[737] Elles sont toutefois admissibles à titre d’exception à la règle de common law excluant le ouï‑dire contenant les aveux d’une partie.
[738] Si j’estimais inadmissible la transcription des déclarations de M. Stewart sur l’insistance d’Idenix, je tirerais contre elle une inférence défavorable parce qu’elle n’a pas appelé un témoin ayant eu connaissance des faits et censé vouloir assister cette partie (The Law of Evidence, art. 6.450, R c Jolivet, 2000 CSC 20, au paragraphe 25).
[739] Comme Mme Wang travaillait sous la direction de M. Stewart, cette preuve contradictoire diminuerait également le poids que j’attribuerais à sa déposition, puisque la corroboration de M. Stewart n’est pas envisageable.
[740] J’ajoute d’ailleurs que la preuve de l’un ou l’autre témoin n’aurait pas eu d’effet causal sur la conclusion que l’ensemble de la preuve m’a permis de tirer, à savoir que l’étape de fluoration dans la synthèse du nucléoside 2’‑C‑Me/F en 2003 n’était pas suffisamment divulguée au moyen des connaissances générales courantes et des essais courants.
2) La preuve de M. Stewart et de Mme Wang
[741] Je résume ainsi la preuve des deux témoins émanant de l’instance britannique :
a) M. Stewart a obtenu une maîtrise en chimie de l’Université de Durham en 1999 puis un doctorat en chimie organique de l’Université d’Oxford en 2003, après avoir étudié sous la direction du professeur George Fleet.
b) M. Stewart et Mme Wang ont reçu un rapport résumant les travaux de M. Griffon.
c) Ils ont tous deux obtenu des produits de départ du site d’Idenix à Montpellier.
d) Le 10 mai 2004, M. Stewart a rencontré M. Fleet, qui lui a offert ses commentaires concernant le projet de synthèse du composé 2’‑C‑Me/F.
e) M. Stewart s’entretenait aussi toutes les semaines avec ses collègues du groupe au sujet du projet 2’‑C‑Me/F.
f) M. Stewart a effectué une recherche documentaire approfondie concernant le projet 2’‑C‑Me/F, recherche ayant nécessité en moyenne deux heures par jour pendant six mois.
g) La première voie de synthèse prévue par M. Stewart, et qu’il avait élaborée avec M. Fleet en mai 2004, comportait une fluoration à l’aide du TBAF ou du TASF, et non du DAST. Cependant, le produit de départ proposé qui devait être obtenu de M. Fleet était trop instable pour être envoyé.
h) La première réaction entreprise par M. Stewart en novembre 2004 dans le cadre du projet 2’‑C‑Me/F a consisté à fluorer un sucre nucléosidique 2’‑C‑Me/OH (comme M. Coe l’avait recommandé), ce qui a donné un composé à fluor (haut) et méthyle (bas) en 2’ (c.‑à‑d. le mauvais stéréoisomère du composé). C’était là l’inverse du but ultime recherché, mais M. Stewart a jugé que la réaction fournirait des renseignements utiles. Il l’a décrite comme une « percée » quand il a découvert qu’elle avait été une réussite.
i) Bien qu’il ait réussi à fabriquer le « mauvais » sucre, il considérait les résultats de la « bonne » fluoration comme incertains en disant [traduction] : « Il n’est pas du tout sûr que la [bonne stéréochimie] fonctionnera de la même façon pour la fluoration parce que l’encombrement stérique et la réactivité des fonctions alcool sont différents. »
j) Quand M. Stewart a essayé la fluoration sur le « bon » produit de départ, le résultat a été un mélange compliqué révélé par CCM. Il a jugé que cette réaction était un échec.
k) M. Stewart a connu un certain nombre de réactions ratées avec le DAST.
l) Ce n’est qu’après avoir reçu des informations d’un employé de Pharmasset à qui elle faisait passer un entretien d’embauche qu’Idenix a décidé de concentrer de nouveau ses efforts sur l’approche du nucléoside et d’abaisser la température de réaction du DAST sur le nucléoside.
m) Le 12 janvier 2005, M. Storer a informé M. Stewart par courriel que M. Gosselin lui avait appris que [traduction] « quelqu’un [que M. Gosselin avait] interviewé juste après Noël et qui travaillait chez Pharmasset lui avait dit qu’ils avaient fabriqué le composé à partir d’un nucléoside, ce qui est peut‑être une bonne nouvelle en ce qui concerne l’autre approche évoquée par Alistair [Stewart] ».
n) M. Stewart a répondu que cette information pouvait être [traduction] « très utile et permettre de rétrécir un peu le champ ». Il a ajouté que, sur la foi de cette information, il allait de nouveau concentrer ses efforts sur l’approche du nucléoside et ferait varier un certain nombre de conditions, dont la température.
m) Pendant ce temps, Mme Wang était récemment entrée chez Idenix. En décembre 2004, elle a tenté de synthétiser un nucléoside 2’‑C‑Me/F fluoré à l’aide du DAST (dans un solvant de dichlorométhane) en utilisant un composé nucléosidique à base uracile comme produit de départ. La tentative a échoué à cause d’une réorganisation chimique.
o) Je conclus que l’information que M. Stewart a reçue de l’employé de Pharmasset a probablement été communiquée à Mme Wang, laquelle a entrepris dès le lendemain une réaction avec le DAST à une température réduite en utilisant un autre composé nucléosidique à base cytosine au lieu d’uracile comme produit de départ. Idenix prétend que Mme Wang a réussi à créer le nucléoside 2’‑C‑Me/F en janvier 2005. Il est toutefois admis qu’elle a mis un point d’interrogation à côté de ce composé dans son rapport mensuel, parce qu’elle ne savait pas au juste si le composé désiré avait bel et bien été produit.
p) La preuve révèle que, par la suite, un composé nucléosidique 2’‑C‑Me/F a été synthétisé à l’aide du DAST en mars, mais suivant toutes les conditions recommandées par la publication WO de Clark du 13 janvier 2005.
3) Analyse
[742] Idenix fait valoir que M. Stewart et Mme Wang, ayant reçu les notes de M. Griffon, auraient été éloignés de la piste menant directement à la fluoration à l’aide du DAST. Je conviens avec Gilead qu’il s’agit là d’une conjecture contredite par la preuve dont je dispose.
[743] M. Stewart a suivi le conseil de M. Fleet et, qui plus est, a entrepris une recherche documentaire approfondie avant d’entamer ses expériences. Je suis d’avis que, après avoir travaillé plus de 18 mois et expérimenté un vaste éventail de réactifs de fluoration, M. Griffon n’aurait pas été en mesure de donner quelque conseil ou instruction que ce soit sur les voies de synthèse à suivre.
[744] Vu tout ce que M. Stewart a consacré comme temps et analyse dans son travail et ses expériences infructueuses, Idenix a manifestement choisi de mettre l’accent sur les travaux de synthèse de Mme Wang. Idenix laisse entendre que, après moins d’un mois de participation au projet et sans expérience antérieure des réactions de fluoration ni du travail avec le DAST, Mme Wang aurait par elle‑même franchi toutes les étapes nécessaires à la synthèse de la molécule 2’‑C‑Me/F, et ce, sans qu’Idenix reconnaisse même qu’elle relevait de M. Stewart.
[745] Idenix soutient également que son succès n’est pas attribuable à l’information provenant de l’employé de Pharmasset ou à son brevet. J’estime que son compte rendu des événements est trop vague pour être digne de foi : elle ne se rappelait même pas dans quelles circonstances elle avait commencé à prendre part au projet.
[746] M. Stewart n’a progressé qu’après avoir reçu les informations obtenues de l’ancien employé de Pharmasset. Il est revenu à la fluoration d’un nucléoside et au travail avec le DAST à une température réduite. Mme Wang, récemment arrivée sans expérience de la fluoration ni du travail avec le DAST, s’est mise à expérimenter dans le même projet de fluoration, comme elle le décrit, [traduction] « en ce sens que nous discutions de ce que faisait chacun de nous », tout en étant supervisés par lui.
[747] Je suis convaincu que la coïncidence commode entre les informations tirées d’un employé de Pharmasset et le dépôt subséquent de sa demande de brevet explique en partie qu’Idenix ait réussi à synthétiser le nucléoside 2’‑C‑Me/F. La preuve présentée par M. Wnuk atteste que ces employés se sont appuyés sur les informations de Pharmasset pour synthétiser le composé cible. Je n’attribue que peu de poids au fait qu’Idenix ait réussi à synthétiser le composé 2’‑C‑Me/F en 2005.
[748] Quoi qu’il en soit, les travaux de M. Stewart et ceux de Mme Wang, dont les activités dépendaient à mon avis largement des travaux du premier, confirment qu’il fallait effectuer une recherche approfondie avant d’entamer les expériences, notamment en consultant d’autres scientifiques. Cette preuve confirme l’évidence, à savoir qu’il n’était pas possible de synthétiser le composé 2’‑C‑Me/F en s’appuyant sur les connaissances générales courantes et sans le secours d’une recherche approfondie et d’expériences par tâtonnement.
H. Les travaux de Jeremy Clark
[749] Idenix invoque la preuve selon laquelle M. Clark avait pu fabriquer à l’aide du DAST un analogue nucléosidique 2’‑C‑Me/F avec une rapidité et une facilité relatives en s’appuyant sur l’article de Matsuda pour la synthèse du composé intermédiaire 2’‑C‑OH/Me.
[750] À titre indicatif, M. Clark a été embauché à Pharmasset après avoir obtenu une maîtrise ès sciences en chimie de l’Université du Tennessee en 2001. Il a commencé à travailler pour Pharmasset le 23 juillet 2001 sans aucune expérience de travail sur les nucléosides fluorés. Le 6 décembre 2002, ses carnets font mention pour la première fois d’un nucléoside 2’‑C‑Me/F à la page 25.
[751] Idenix souligne que, bien que M. Clark n’ait eu aucune expérience préalable des nucléosides fluorés et n’ait pas possédé la formation d’un chimiste versé dans l’art, il a quand même réussi à fabriquer le composé 2’‑C‑Me/F à sa première fluoration au DAST le 27 janvier 2003. Le 17 février 2003, il a répété sa fluoration au DAST sur le même glucide protégé. Une certaine confusion règne au sujet de ces dates, étant donné que l’article publié en 2005 par Clark et al. mentionnait que cette équipe était la première à inventer un nucléoside 2’‑C‑Me/F. Cette affirmation est cependant contraire à ce que disent les carnets de M. Clark, lesquels sont très mal tenus.
[752] Idenix tente aussi d’invoquer une déclaration de M. Clark d’après laquelle la synthèse complète à l’aide du DAST était une réaction de 15 minutes. Sans vouloir être trop sévère à l’égard de M. Clark, qui n’a pas été appelé à témoigner, la Cour accepte néanmoins le portrait qu’en a donné M. Patterson d’après divers commentaires assez désobligeants, et qui est celui d’un individu enclin à faire valoir très ouvertement ses talents et ses opinions. Son rapport du 28 février 2003 illustre sans doute le comportement singulier de M. Clark, dans lequel il fait état de son schéma de réaction au DAST pour la synthèse du nucléoside en disant [traduction] : « Cette séquence de réactions fera un bon chapitre dans les annales des sciences foireuses. Cette chimie n’a rien d’élégant », mais [traduction] « elle est quand même acceptable à ce stade‑ci ».
[753] M. Patterson a témoigné que M. Kris Pankiewicz avait conseillé à M. Clark d’utiliser le DAST sur un composé 2’‑C‑OH/Me parce que ce réactif était couramment employé pour convertir les alcools en fluorures dans les systèmes tertiaires. C’est pourquoi Idenix prétend que les chimistes de Pharmasset ont fabriqué le composé 2’‑C‑Me/F en suivant la même méthode que celle décrite par les chimistes experts en l’espèce.
[754] M. Clark a préparé le composé 2’‑C‑Me/F par l’approche du nucléoside. Il mentionne à ce sujet dans son carnet de laboratoire qu’il suivait [traduction] « exactement la procédure présentée par Matsuda ». Idenix soutient que ce fait vient encore étayer l’analyse précédente dans le cadre de laquelle il avait été démontré que la personne versée dans l’art connaîtrait ou découvrirait Matsuda et suivrait ses enseignements.
[755] M. Clark a fait d’autres renvois au même article de Matsuda aux pages 81, 83 et 92 de son carnet de notes 2. Dans un rapport sommaire préparé par lui le 21 juillet 2003, M. Clark soulignait que le plan de fabrication d’un nucléoside 2’‑C‑Me/F [traduction] « était inspiré des travaux de Matsuda ». Idenix soutient donc que, pour fabriquer le composé revendiqué, il ne fallait que l’article de Matsuda et un laps de quinze minutes.
[756] Pharmasset a fait des efforts pour accroître le rendement, ce dont témoigne le procès‑verbal de la rencontre de chimie qu’elle a tenue le 22 août 2003. Idenix allègue que le compte rendu fait état d’une recherche documentaire sur la fluoration de carbones tertiaires qui aurait permis de recenser plus de 100 articles. Idenix oppose ces résultats à la recherche erronée de Griffon, qui n’avait trouvé que deux références.
[757] Toutefois, la Cour ignore la source des renseignements d’Idenix. La pièce que mentionne cette dernière à l’appui de ces allégations précise seulement ce qui suit : [traduction] « [p]résentation des résultats de la recherche documentaire sur les agents de fluoration ». Le compte rendu rappelle une discussion ayant porté sur un certain nombre d’agents fluorants comme le DAST et le Deoxo‑Fluor®, ainsi que le HF et le NFTh. Rien dans cette pièce n’indique que la recherche s’est limitée à la fluoration de carbones tertiaires, mais, selon un commentaire, [traduction] « plusieurs références ont été répertoriées, sans être présentées, sur la fluoration de carbones tertiaires à haut rendement et sans qu’un mécanisme quelconque soit mentionné ». À cette rencontre, on semble avoir mis l’accent sur l’obtention de rendements plus élevés.
[758] Idenix affirme également que, dans ce compte rendu de la rencontre de chimie, il est dit que M. Wojciech J. Stec, directeur, Chimie chez Pharmasset, avait affirmé que tout le monde continuait à utiliser le DAST et que celui‑ci était l’[traduction] « approche conservatrice ». Cet énoncé laisse croire que le DAST était déjà largement en usage à Pharmasset avant la recherche documentaire ayant permis de recenser plus de 100 articles.
[759] Toutefois, en consultant la même pièce, M. Stec a souligné que, à son arrivée, il avait distribué des articles sur la fluoration, [traduction] « mais, malgré tout, tout le monde continu[ait] d’utiliser le DAST ». Il a fait remarquer que le DAST n’était pas employé dans l’industrie. Il a conseillé ceci aux chimistes : [traduction] « [n]e soyez pas conservateurs (en utilisant le DAST) ». Il a suggéré l’utilisation de différents agents fluorants pour accroître le rendement. Ce témoignage semble révéler que Pharmasset utilisait déjà le DAST de préférence aux nombreux agents fluorants disponibles. Sa prédilection pour le DAST pourrait avoir contribué à ce que les chimistes principaux recommandent par simple habitude à M. Clark d’y avoir recours. Cela n’était clairement pas le cas chez Idenix ni ne représente l’opinion d’autres chimistes d’expérience ayant été associés à la synthèse ou consultés à ce sujet.
[760] Le 19 septembre 2003, M. Clark a utilisé le Deoxo‑Fluor® pour fabriquer à grande échelle un PSI‑6130 protégé par un benzoyle. Il a déclaré qu’une fluoration par Deoxo‑Fluor® avait donné un nucléoside protégé avec un rendement de 23 %. L’expérience sous‑jacente figure à la page 118 du carnet no 2 de M. Clark (pièce 23‑I), ce dernier précisant avoir recouru à la chromatographie sur colonne pour purifier le produit cible protégé. Ainsi, M. Clark a lui aussi réussi à fabriquer le composé cible fluoré à son premier essai avec le Deoxo‑Fluor®.
[761] À mon avis, Idenix exagère la facilité avec laquelle M. Clark aurait synthétisé le composé 2’‑C‑Me/F. D’abord, M. Patterson avance que M. Watanabe aurait été le premier chez Pharmasset à consigner la structure du composé 2’‑C‑Me/F. Il l’a présenté comme l’un des analogues du composé d’Idenix à un groupe de chimistes en précisant qu’il désirait que les membres de l’équipe de chimie envisagent d’en faire la synthèse.
[762] Par ailleurs, en ce qui concerne les voies de synthèse, M. Clark a d’abord essayé l’approche de la gemcitabine et n’est passé à celle du cycle glucidique qu’après un échec. De plus, il a déclaré qu’un chimiste principal d’expérience lui avait conseillé de fabriquer le composé en utilisant l’approche du nucléoside parce qu’il avait du mal à progresser. Le chimiste versé dans l’art n’a pas besoin d’effectuer une recherche dans les publications s’il suit les conseils d’un chimiste principal de l’organisation. M. Patterson a déclaré ce qui suit dans son témoignage :
[traduction]
Il y a eu, vous savez, des discussions. Il lui a fallu longtemps pour arriver quelque part. Les gens se sont mis à lui donner des conseils, particulièrement Chris Pankiewicz, en lui demandant de le fabriquer avec la cytosine et de partir du nucléoside plutôt que d’essayer d’effectuer le couplage.
Et je pense que c’était là une voie bien plus rapide et plus viable du fait que vous n’avez pas à vous soucier, vous savez, de la préparation de tous les stéréocentres qui découleraient de la synthèse du glucide, la nature s’étant chargée du gros du travail pour vous.
[763] M. Patterson est revenu sur ce point et notamment sur le fait que M. Clark n’avait pas suivi le conseil :
[traduction]
Q. Ainsi, lorsque M. Clark se met à ses premiers travaux de chimie – je pense que vous avez dit le glucide ou sa fluoration –, pourriez‑vous seulement nous dire si quelqu’un lui a donné des conseils à ce sujet?
R. Oh, oui.
Q. Et quel était le conseil?
R. Le conseil donné était de partir du nucléoside, du C.
Q. Et comment M. Clark réagissait‑il lorsqu’il recevait des instructions?
R. Pas bien.
[764] En d’autres termes, M. Clark a commencé par l’approche de la gemcitabine. Les autorités principales du service de chimie lui ont conseillé de prendre l’approche du nucléoside et, apparemment, il aurait synthétisé le premier composé par l’approche du cycle glucidique pour ensuite répéter ce succès par l’approche du nucléoside avec des rendements plus élevés.
[765] De même, M. Clark n’en serait pas venu par lui‑même à la fluoration au DAST, recevant là encore les conseils de chimistes principaux avec qui il travaillait, selon le témoignage de M. Patterson :
[traduction]
M. Patterson, vous avez mentionné que des conseils avaient été donnés concernant, je pense que vous avez dit le nucléoside et la cytosine?
R. Exact.
Q. Des conseils ont‑ils aussi été donnés sur les agents de fluoration?
R. Je pense que oui.
Q. Et qu’est‑ce qui était conseillé?
R. Le DAST ou, vous savez, un trifluorure d’aminosulfure similaire.
[766] Il appert aussi clairement que M. Clark recevait des conseils de nombreux membres du groupe de chimie de Pharmasset. L’article publié en 2005 dont il était l’auteur principal nommait les coauteurs suivants : Laurent Hollecker, J. Christian Mason, Lieven J. Stuyver, Phillip M. Tharnish, Stefania Lostia, Tamara R. McBrayer, Raymond F. Schinazi, Kyoichi A. Watanabe, Michael J. Otto, Phillip A. Furman, Wojciech J. Stec, Steven E. Patterson et Krzysztof W. Pankiewicz.
[767] À noter également que M. Patterson a témoigné que tout le monde était fort excité quand M. Clark avait trouvé ce « trou » dans le brevet d’Idenix. La preuve montre clairement que la synthèse du composé 2’‑C‑Me/F était une grande priorité d’Idenix. Je ne crois pas que ce serait trop spéculer que de conclure que Pharmasset aurait bien vu la possibilité que donnait l’omission de l’analogue fluoré dans le brevet d’Idenix.
[768] D’après M. Patterson, M. Clark s’est vu confier cette tâche parce qu’il avait noté que cet élément n’était pas couvert par le brevet. Il avait beaucoup de difficultés à avancer et, d’après M. Patterson, il recevait les conseils de divers chimistes principaux. Compte tenu de son inexpérience, ainsi que de son manque de formation officielle si l’on en juge par le piètre état de ses carnets, je conclus qu’il est improbable qu’il ait été livré à lui‑même pour synthétiser le composé. M. Otto a décrit le groupe comme une équipe très unie de chimistes spécialisés dans la découverte de médicaments travaillant très près les uns des autres. Des éléments de preuve laissent croire que M. Stuyver pourrait avoir aussi aidé M. Clark à choisir la cible de la synthèse.
[769] Même s’il n’avait pas nécessairement la formation d’un chimiste versé dans l’art, il est probable que M. Clark aurait pu, s’il faisait partie d’une équipe de découvertes chimiques efficace et très expérimentée, exercer ses fonctions à un niveau d’expérience et de connaissances dépassant celui d’un tel chimiste.
[770] Cependant, je ne veux pas médire de M. Clark, puisqu’il semblait en effet être le genre d’individu qui trace sa propre route, est plein de confiance en lui et possède certains des attributs naturels de l’inventeur. M. Patterson le décrit comme quelqu’un ayant une grande assurance et des idées très affirmées : [traduction] « Jeremy Clark avait des idées très concrètes sur la manière de fabriquer cette molécule. Il mettait beaucoup d’ardeur dans ses efforts de synthèse, et le faisait savoir à tout le monde ». M. Patterson a ajouté, dans la même veine : [traduction] « Eh bien, M. Clark était très exubérant. Et lorsqu’il était sûr de quelque chose, il en était certain, et tous ceux qui le connaissaient le savaient ». Ce n’est pas, il me semble, la description du chimiste versé dans l’art conventionnel et non inventif.
[771] Dans la cause analogue entre ces mêmes parties au Royaume‑Uni, le juge Arnold a laissé entendre que la chance aurait pu jouer dans l’invention par M. Clark du composé 2’‑C‑Me/F. Par contre, il se peut très bien que M. Clark soit l’un de ces individus particulièrement doués pour absorber rapidement une quantité considérable d’informations et trouver ensuite intuitivement des solutions inventives à partir des multiples options qui lui sont présentées. Il aurait relevé l’omission dans la liste des composés 2’‑C‑Me/F visés par le brevet d’Idenix et n’aurait suivi les conseils que lorsque bon lui semblait. Il a aussi opté pour le toluène parmi un certain nombre de solvants et de conditions réactionnelles.
[772] Outre l’aide qu’il aurait reçue de ses collègues, il est impossible de déterminer dans quelle mesure le talent inventif de M. Clark ou la chance l’a conduit à la synthèse du composé 2’‑C‑Me/F.
[773] Quelle que soit l’explication de la rapidité relative avec laquelle M. Clark a réussi la synthèse du composé 2’‑C‑Me/F après le faux départ avec la gemcitabine, la Cour n’est pas convaincue que sa réussite est le résultat ou le reflet des connaissances générales courantes et d’essais courants qui, selon Idenix, expliquent cette réussite. Comme je l’ai mentionné, divers facteurs pourraient entrer en ligne de compte, dont une préférence « conservatrice » pour le DAST chez Pharmasset, préférence non nécessairement suivie par les chimistes versés dans l’art.
[774] La performance de M. Clark n’infirme certainement pas les conclusions de l’analyse des nombreuses questions et de la preuve examinée plus haut, qui démontrent l’inexistence de connaissances générales courantes concernant la synthèse des nucléosides 2’‑C‑Me/F et l’utilisation du DAST à cette fin. C’est ce que confirme également la preuve intéressant les travaux et les contributions d’autres chimistes expérimentés en 2002 et en 2003.
[775] La Cour conclut que l’allégation d’Idenix, selon laquelle les connaissances générales courantes et les expériences permises complétaient la divulgation écrite et constituaient de ce fait une divulgation permettant de synthétiser le nucléoside 2’‑C‑Me/F, n’est pas étayée par la preuve. La divulgation de la synthèse de ce composé dans le brevet 191 est donc insuffisante.
IX. La portée excessive
A. Introduction
[776] Gilead a quelque peu modifié son argument sur la portée excessive par rapport à sa thèse initiale afin d’avancer deux nouveaux arguments en ce sens. Ceux‑ci concernent le défaut d’Idenix d’avoir fabriqué le composé 2’‑C‑Me/F aux dates de dépôt et de publication.
[777] Gilead a d’abord fait valoir qu’Idenix avait, dans les limites de ses revendications, des composés qui n’avaient pas été fabriqués ou qui ne pouvaient l’être. Cette thèse concerne les nombreux composés de la revendication 1 et la base de ces composés. Comme la Cour a accepté l’abandon de la revendication 1 et l’interprétation restreinte donnée par le chimiste de l’étendue des composés dotés de la base revendiquée, je conclus que l’argument de la portée excessive n’a plus sa place.
B. Les principes généraux
[778] La portée excessive découle de l’exigence énoncée au paragraphe 27(4) de la Loi selon laquelle le mémoire descriptif se termine « par une ou plusieurs revendications définissant distinctement et en des termes explicites l’objet de l’invention dont le demandeur revendique la propriété ou le privilège exclusif ».
[779] Il est admis par les parties [traduction] « [qu’]aucun inventeur ne peut prétendre à un monopole s’étendant à plus, ou même un petit peu plus, que ce qu’il invente » (Radio Corporation of America c Hazeltine Corporation (1981), 56 CPR (2d) 170 at 188). Comme l’a déclaré la Cour suprême du Canada dans l’arrêt Burton, au paragraphe 16 :
Plusieurs arrêts signalent qu’un inventeur est libre de formuler ses revendications aussi étroitement qu’il le juge à propos dans le but de se protéger de l’invalidité qui pourrait résulter d’une formulation trop générale. En pratique, cette liberté est vraiment très limitée car le brevet peut avoir aussi peu de valeur que s’il était invalide si, pour éviter toute possibilité d’invalidité, il laisse un champ inoccupé entre ce que représente l’invention telle que divulguée et ce qui est visé par les revendications.
C. Les observations des parties
[780] Gilead fait valoir que les revendications du brevet 191 ont une portée excessive selon un raisonnement que je résumerais ainsi :
(i) au moment où la demande de brevet a été déposée et publiée, Idenix n’avait pas réussi à fabriquer un composé relevant des revendications; comme elle n’a pas fabriqué les composés revendiqués, elle ne peut être réputée avoir complété l’invention;
(ii) n’ayant pas inventé les composés, toute revendication les concernant a par définition une portée excessive.
[781] L’argument est nouveau. Pour cette raison, je le reproduirai mot pour mot :
[traduction]
a. Ce sujet soulève deux questions fondamentales : (i) à quel moment une invention est‑elle réalisée, et (ii) à quel moment peut‑on dire que quelqu’un a inventé une classe de composés?
b. Dans le vieil arrêt Christiani c Rice, la Cour suprême a énoncé les principes suivants, qui ont été invoqués à maintes reprises par la jurisprudence :
[traduction] Il ne suffit pas que quelqu’un affirme qu’une idée lui trottait dans la tête; […]
[…]
[L]a date de la découverte est celle à laquelle l’inventeur peut prouver qu’il a formulé pour la première fois, par écrit ou verbalement, une description qui fournit les moyens de fabriquer ce qui est inventé.
[Souligné par Gilead.]
c. La jurisprudence canadienne en dit très peu sur le moment à partir duquel on peut affirmer qu’un composé a été inventé. Cependant, la jurisprudence américaine en cette matière est considérable, en grande partie parce que jusqu’à très récemment, les États‑Unis utilisaient un système fondé sur le « premier à inventer » qui obligeait souvent la Cour à établir les dates des inventions.
d. En droit américain, on ne peut affirmer qu’un composé a été inventé que lorsque l’inventeur en a l’idée et dispose d’un moyen utilisable de le fabriquer. (Voir par exemple Oka et al v Youssefyeh et al, 849 F.2d 581 (Cir féd), au par. 3).
e. Au cours de l’instruction, Idenix a soumis à la Cour un certain nombre de décisions américaines. Chacune d’elles peut être distinguée du cas présent. Aucune ne permet d’affirmer qu’un brevet peut être obtenu à l’égard d’une chose que l’inventeur ne sait pas comment fabriquer. Même si le droit américain (et canadien) n’exige pas de l’inventeur qu’il ait véritablement fabriqué chacun des composés revendiqués, la loi exige qu’il dispose d’un moyen de les fabriquer, et qu’il divulgue cette méthode dans le brevet.
f. Ceci est conforme au principe général adopté dans l’arrêt Christiani c Rice, [1930] SCR 443, aux pages 454 et 456, comme à la politique énoncée par la Cour suprême dans l’arrêt AZT (Apotex Inc c Wellcome Foundation Ltd, 2002 CSC 77, au paragraphe 84) :
i. Le demandeur ne mérite pas un brevet pour une quasi‑invention, dans le cas où la population obtient seulement une promesse selon laquelle une hypothèse pourrait s’avérer ultérieurement utile; cela aurait pour effet d’autoriser et d’inciter les demandeurs de brevet à réserver des idées intéressantes et à attendre que la science soit suffisamment avancée pour qu’elles puissent être réalisées. Le titulaire du brevet aurait alors un droit de propriété l’autorisant à empêcher autrui de fabriquer, vendre, exploiter ou améliorer cette idée, sans que la population bénéficie de quelque contrepartie utile.
[Souligné par Gilead.]
g. Aux dates de dépôt et de publication du brevet 191, autant que les inventeurs nommés aient pu le savoir, ils n’avaient qu’échoué dans leurs tentatives de synthétiser un nucléoside 2’‑fluoro (bas)-2’‑méthyl (haut). Comme ils ne connaissaient aucune façon de synthétiser l’un ou l’autre des composés visés par la revendication, ils n’ont pas décrit de méthode à cet égard dans le brevet.
h. On ne peut pas affirmer que les inventeurs nommés étaient en possession d’une invention à la date de dépôt ou de publication du brevet 191. Pour reprendre les termes employés par la Cour suprême dans l’arrêt AZT, les inventeurs avaient une idée intéressante en avance sur l’état de la science. Le brevet 191 accordait à Idenix un monopole sans rien donner d’utile au public en retour.
i. Comme Idenix n’avait pas effectivement inventé des composés nucléosidiques 2’-fluoro (bas)-2’‑méthyl (haut), toute revendication portant sur de tels composés est par définition d’une portée excessive.
[Non souligné dans l’original.]
D. Analyse
[782] Gilead ajoute effectivement à l’obligation déjà existante pour l’inventeur de pouvoir décrire le mode de fabrication de l’invention la condition de devoir disposer d’un moyen de la réaliser. Comme le révèle l’extrait de l’arrêt Wellcome/AZT d’après lequel aucun brevet n’est accordé lorsque le public n’obtient que la promesse qu’une hypothèse pourra ultérieurement s’avérer utile, Gilead soutient que le breveté revendique un monopole à l’égard d’un projet de recherche, chose qui n’est pas chèrement monnayée.
[783] Idenix réplique, compte tenu de la logique du paragraphe « g » susmentionné, que, selon la définition de l’invention, telle qu’elle figure aussi dans l’arrêt Christiani c Rice, [1930] SCR 443, il n’est pas nécessaire que l’inventeur dispose d’un moyen de fabriquer le composé ([traduction] « une description qui fournit les moyens de fabriquer ce qui est inventé ») s’il peut adéquatement divulguer la manière de le réaliser, en présumant aussi qu’il peut valablement prédire son utilité.
[784] Idenix soutient simplement que, si les revendications sont valablement prédites et que le mode de réalisation de l’invention est suffisamment divulgué, alors les revendications ne peuvent pas avoir une portée excessive. Je souscris à cette observation, eu égard à l’état actuel du droit canadien.
[785] Toute difficulté liée au fait que l’inventeur n’a pas fabriqué le composé est censée être prise en compte dans les restrictions imposées aux brevets visant des composés non fabriqués, l’inventeur étant tenu de valablement prédire l’invention et de suffisamment divulguer sa synthèse. Il se trouve que ces restrictions opèrent très bien en l’espèce, puisque j’estime que le brevet 191 est invalide pour les deux motifs. Cependant, comme le prétend ici Gilead, il ne s’agit pas d’une règle impérative qui permet de rejeter l’action sans tenir de procès, et qui comporte toutes les contestations regardant la preuve et les questions juridiques qui s’ensuivent normalement.
[786] Quoique j’approuve l’observation sous‑jacente de Gilead selon laquelle Idenix ne devrait pas être récompensée de ne pas avoir fabriqué de composé, je ne pense pas que le nouveau principe qu’elle cherche à faire valoir puisse être rattaché à la doctrine de la portée excessive. Suivant la notion de portée excessive, le brevet peut être valide même si l’inventeur a revendiqué un domaine trop vaste. C’est de cet espace entre la validité et la portée excessive, et qui dépend de la formulation de la revendication, ainsi que l’énonce l’extrait précité de l’arrêt Burton, dont il s’agit.
[787] Le véritable argument de Gilead consiste à dire que, dans la présente affaire, dès l’origine, le brevet est sans fondement puisque l’invention n’a jamais été réalisée malgré les efforts déployés en ce sens, et il n’aurait jamais dû être accordé. Si la règle veut que l’inventeur doive disposer d’un moyen de fabriquer les composés revendiqués et pouvoir le divulguer, je crains que cela n’ouvre la porte à de nouvelles contestations revenant à exiger un moyen de réaliser toutes les inventions non fabriquées à la date de la divulgation, mais cela toucherait aussi les inventions valablement prédites. Je crois également qu’il s’agit ici d’une situation exceptionnelle peu susceptible de se reproduire.
[788] Il est possible d’avancer comme corollaire logique et harmonieux de la doctrine de la prédiction valable que l’invention que l’inventeur a tenté sans succès de réaliser ne peut être brevetée. Il s’agirait alors de lier la connaissance de l’inventeur requise aux fins de la prédiction valable de l’utilité à la date de dépôt, avec celle simultanée qu’il n’a pas su réaliser l’invention malgré ses tentatives. Gilead n’a toutefois pas fait valoir cette analyse, qui n’est donc pas soumise à la Cour. Comme je l’ai déjà mentionné, cet argument ne semble pas nécessaire puisque le brevet 191 d’Idenix a été jugé invalide sur le fondement de principes bien établis en droit des brevets.
[789] En conclusion, je ne pense pas qu’une allégation de portée excessive puisse être avancée contre d’Idenix en l’espèce pour les motifs invoqués par Gilead.
X. La demande reconventionnelle d’antériorité d’Idenix
A. Introduction
[790] Idenix soutient notamment dans sa demande reconventionnelle que chacune des revendications du brevet 657 était antériorisée par la divulgation et le caractère réalisable de leur objet dans le brevet 191 déposé le 27 juin 2003 et publié le 8 janvier 2004. Elle sollicite une déclaration aux termes du paragraphe 60(1) de la Loi sur les brevets portant que le brevet 657 est invalide suivant le paragraphe 28.2(1) de la Loi.
[791] Le paragraphe 28.2(1) de la Loi sur les brevets dispose notamment :
|
28.2(1) L’objet que définit la revendication d’une demande de brevet ne doit pas : |
28.2(1) The subject‑matter defined by a claim in an application for a patent in Canada (the “pending application”) must not have been disclosed
|
|
[…] |
[…] |
|
b) avant la date de la revendication, avoir fait, de la part d’une autre personne, l’objet d’une communication qui l’a rendu accessible au public au Canada ou ailleurs;
|
(b) before the claim date by a person not mentioned in paragraph (a), in such a manner that the subject‑matter became available to the public in Canada or elsewhere; |
|
c) avoir été divulgué dans une demande de brevet qui a été déposée au Canada par une personne autre que le demandeur et dont la date de dépôt est antérieure à la date de la revendication de la demande visée à l’alinéa (1)a);
|
(c) in an application for a patent that is filed in Canada by a person other than the applicant, and has a filing date that is before the claim date.
|
[792] Les parties conviennent, à seule fin de simplifier la présente action au Canada, que la date de la demande à l’égard du brevet 657 est celle du dépôt, soit le 21 avril 2004.
[793] La question du caractère réalisable de la divulgation aux fins de l’antériorité a été largement résolue par l’analyse au terme de laquelle j’ai conclu que le brevet 191 ne divulguait pas adéquatement le mode de fabrication du nucléoside 2’‑C‑Me/F. Cette analyse s’applique également au caractère réalisable de la divulgation aux fins de l’antériorité.
[794] Je suis donc amené à analyser brièvement l’interprétation des revendications du brevet 657, avant d’évoquer les questions touchant à la divulgation de l’invention que Gilead a plaidées un peu différemment au regard de l’antériorité que dans ses observations concernant l’insuffisance.
1) L’interprétation des revendications du brevet 657
[795] La personne versée dans l’art aurait compris que chacune des revendications du brevet 657 vise des nucléosides cytidine et uridine et des nucléotides 2’-fluoro (bas)-2’-méthyl (haut) et que la portée des revendications se réduit à deux composés en particulier, à savoir la (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine et la (2’R)‑2’-désoxy-2’-fluoro-2’-C-méthylcytidine.
a) La revendication 1 du brevet 657
[796] La personne versée dans l’art aurait compris que les composés de la revendication 1 pouvaient généralement être décrits comme des nucléosides 2’‑C‑Me/F porteurs d’une base cytosine ou uracile pouvant être illustrés de la manière suivante :
[797] Par ailleurs, la personne versée dans l’art aurait compris que la revendication 1 du brevet 657 de Gilead vise des composés (ou leurs sels pharmaceutiquement acceptables) avec les constituants suivants :
(i) une base cytosine ou uracile naturelle;
(ii) un cycle glucidique contenant un oxygène (O);
(iii) un groupe méthyle (CH3) en position 2’ (haut);
(iv) un atome de fluor (F) en position 2’ (bas);
(v) un des choix de substituants en position 3’, soit l’hydroxyle, le monophosphate, le diphosphate, le triphosphate, le H‑phosphonate et d’autres;
(vi) un des choix de substituants en position 5’, soit l’hydroxyle, le monophosphate, le diphosphate, le triphosphate, le H‑phosphonate et d’autres.
b) La revendication 2 du brevet 657
[798] La revendication 2 limite à l’hydroxyle les choix en position 3’ (bas). Par conséquent, la personne versée dans l’art aurait compris que les composés visés par la revendication 2 peuvent être représentés ainsi :
[799] De plus, R1 se limite à trois choix possibles (monophosphate, diphosphate et triphosphate). La personne versée dans l’art aurait donc compris que la revendication 2 vise six composés (ou leurs sels pharmaceutiquement acceptables) :
(i) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine 5’‑monophosphate;
(ii) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine 5’‑monophosphate;
(iii) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine 5’‑diphosphate;
(iv) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine 5’‑diphosphate;
(v) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine 5’‑triphosphate;
(vi) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine 5’‑triphosphate.
c) La revendication 3 du brevet 657
[800] La revendication 3 limite les composés de la revendication 1 en précisant que R7 est un H, et R1, un diphosphate ou un triphosphate. La personne versée dans l’art aurait compris que la revendication 3 englobe un plus petit nombre de composés que les revendications 1 et 2. Elle aurait compris, en particulier, que la revendication 3 vise les quatre composés suivants (ou leurs sels pharmaceutiquement acceptables) :
(i) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine 5’‑diphosphate;
(ii) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine 5’‑diphosphate;
(iii) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine 5’‑triphosphate;
(iv) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine 5’‑triphosphate.
d) La revendication 4 du brevet 657
[801] La revendication 4 limite les composés de la revendication 1 en précisant que R7 est un H et R1, un triphosphate. La personne versée dans l’art aurait compris que la revendication 4 vise les deux composés suivants :
(i) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine 5’‑triphosphate;
(ii) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine 5’‑triphosphate.
e) La revendication 5 du brevet 657
[802] La revendication 5 limite les composés de la revendication 1 en précisant que et R1 et R7 sont des H. La personne versée dans l’art aurait compris que la revendication 5 vise les deux composés suivants :
(i) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine;
(ii) (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine.
f) La revendication 6 du brevet 657
[803] La revendication 6 limite les composés de la revendication 1 à un seul, à savoir la (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthylcytidine (ou ses sels pharmaceutiquement acceptables) :
g) La revendication 15 du brevet 657
[804] La revendication 15 limite les composés de la revendication 1 à un seul, à savoir la (2’R)‑2’‑désoxy‑2’‑fluoro‑2’‑C‑méthyluridine (ou ses sels pharmaceutiquement acceptables) :
h) Les autres revendications du brevet 657
[805] Les autres revendications du brevet 657 incorporent par renvoi les composés revendiqués. En particulier :
a) Les revendications 7 à 12 visent des compositions pharmaceutiques comprenant les nucléosides des revendications 1 à 6 (revendications 7 à 12 respectivement), ou leurs sels pharmaceutiquement acceptables, et un excipient pharmaceutiquement acceptable;
b) Les revendications 13 et 14 visent des méthodes de synthèse des nucléosides cytidine et uridine 2’‑fluoro (bas)-2’‑méthyl (haut) de la revendication 1;
c) La revendication 16 vise une composition pharmaceutique comprenant le nucléoside de la revendication 15, ou l’un de ses sels pharmaceutiquement acceptables, et un excipient pharmaceutiquement acceptable;
d) Les revendications 17 à 19 visent des compositions liposomales comprenant le composé de la revendication 1, 6, ou 15 (revendications 17, 18 et 19, respectivement) et, à titre facultatif, un excipient pharmaceutiquement acceptable;
e) Les revendications 20 à 26 visent des utilisations des nucléosides revendiqués, ou des compositions comprenant les nucléosides revendiqués, comme agents antiviraux.
2) L’antériorité
a) Le critère de l’antériorité
[806] Le critère de l’antériorité a été énoncé par la Cour suprême du Canada dans l’arrêt (Plavix/Sanofi). Il comprend deux étapes.
a) La divulgation – Le brevet antérieur doit divulguer des informations qui entraîneraient nécessairement une contrefaçon si elles étaient mises à exécution. La personne versée dans l’art prend connaissance de l’antériorité donnée pour savoir si elle divulgue la seconde invention. Cette personne est [traduction] « censée essayer de comprendre ce que l’auteur du brevet antérieur a voulu dire ». À ce stade, il n’y a pas de place pour les expériences par tâtonnement. La personne versée dans l’art lit simplement le brevet pour en saisir la teneur. La preuve à examiner est seulement constituée des antériorités, telles que la personne versée dans l’art les comprendrait.
b) Le caractère réalisable – Si l’exigence de la divulgation est respectée, la Cour doit alors décider si la personne versée dans l’art aurait été en mesure de réaliser l’invention sans trop de difficultés. À ce stade, les essais courants sont permis; cependant, les essais successifs, prolongés ou ardus ne sont pas considérés comme courants. Aux fins du caractère réalisable, la question n’est plus de savoir ce que la personne versée dans l’art dégagerait de la divulgation du brevet précédent, mais si elle est en mesure de réaliser l’invention.
b) Analyse des observations de Gilead
[807] Gilead allègue que le brevet 191 ne divulgue pas l’objet revendiqué dans le brevet 657 :
(i) Le lecteur versé dans l’art ne serait pas en mesure d’identifier le composé actif du brevet 191.
Comme je l’ai mentionné plus haut, je suis convaincu, eu égard à la preuve présentée par MM. Damha et Barrett, que le lecteur versé dans l’art [traduction] « censé essayer de comprendre ce que l’auteur du brevet précédent a voulu dire » reconnaîtrait, en examinant les revendications et les documents pertinents dans le brevet 191, que les composés actifs qu’il vise étaient les composés nucléotidiques et nucléosidiques 2’‑C‑Me/F décrits dans les revendications 2 et 3 et leurs dérivés, avec des bases naturelles similaires à celles du brevet 657. Dans les deux inventions, l’élément essentiel se situe nettement en position 2’ du cycle glucidique. Ce lecteur averti du brevet 191 se rendrait compte que d’autres domaines de l’invention se rapportant à la structure qui est au cœur de la divulgation sont décrits de façon plus générale.
(ii) Le brevet 191, tel qu’il a été déposé et publié, ne mettait pas l’accent sur les composés de la formule IX. En fait, les revendications de ce brevet, tel qu’il a été déposé et publié, visaient toutes les formules et ne se limitaient pas aux composés de la formule IX.
Pour le même motif fondé sur une analyse des revendications, j’accepte l’opinion de MM. Damha et Barrett selon laquelle le lecteur versé dans l’art se rendrait compte que le brevet 191 était basé sur les composés de la formule IX, en reconnaissant qu’il contient beaucoup d’éléments sans pertinence qui devraient être écartés.
(iii) Le brevet 191 ne présente aucune description claire des nucléosides 2’‑C‑Me/F à base cytosine ou uracile et ne dirige pas la personne moyennement versée dans l’art vers le choix des bases cytosine et uracile parmi la multitude de bases évoquées. Il n’y a ni exemples, ni schémas, ni données concernant les nucléosides 2’‑C‑Me/F à base cytosine ou uracile.
Par la même lecture attentive, le lecteur versé dans l’art saurait en raison des connaissances générales courantes que les analogues nucléosidiques servant d’agents antiviraux seraient liés à l’une des quatre bases naturelles, dont la cytosine et l’uracile. Ce serait là une indication suffisante pour une divulgation de l’invention. Gilead n’a pas fait valoir que les bases puriques naturelles n’étaient pas actives.
[808] La description du brevet 191 précise que les composés revendiqués par le brevet 657 ou une composition pharmaceutique comprenant ces composés peuvent servir d’agent antiviral ou, dans le cas des nucléosides revendiqués, qu’ils peuvent servir à la production de promédicaments. Les deux brevets précisent en outre que les composés peuvent servir au traitement contre les Flaviviridae, y compris le VHC. De plus, l’un et l’autre précisent que les composés peuvent être utilisés en association avec d’autres composés antiviraux. Ainsi, les utilisations qui sont divulguées et revendiquées dans le brevet 657 correspondent à celles qui sont divulguées dans le brevet 191. Comme je l’ai évoqué, les mêmes composés sont divulgués dans les deux brevets, plus particulièrement les composés plus limités revendiqués dans les deux brevets qui forment la classe générique.
[809] Par conséquent, je suis convaincu que la même invention visée par le brevet 657 est divulguée dans le brevet 191. La question de savoir s’il y a antériorité de l’objet des revendications du brevet 657 oblige donc à établir si le brevet 191 fournit une divulgation habilitante qui permette au chimiste versé dans l’art de fabriquer les composés relevant des revendications du brevet 657.
[810] Comme j’ai déjà conclu qu’il n’y avait pas de divulgation habilitante du mode de synthèse des composés du brevet 191, l’allégation d’antériorité d’Idenix est rejetée.
[811] Le brevet 191 ne permet pas la réalisation de l’objet revendiqué dans le brevet 657 :
- Il n’y a ni exemples ni schémas concernant la façon de fabriquer les nucléosides 2’‑C‑Me/F avec une base cytosine ou uracile;
- La synthèse des nucléosides 2’‑C‑Me/F était inconnue en 2004;
- Il n’existait pas de connaissances générales courantes quant à la façon de fabriquer des nucléosides porteurs d’un fluor tertiaire en position 2’;
• la personne versée dans l’art n’aurait pas été en mesure de fabriquer des nucléosides 2’‑C‑Me/F sur la base du brevet 191 et des connaissances générales courantes sans expériences excessives, et encore.
XI. La demande reconventionnelle d’Idenix pour contrefaçon
A. Introduction – L’ordonnance de disjonction
[812] Idenix soutient dans sa demande reconventionnelle que Gilead a contrefait certaines revendications de son brevet 191 en fabriquant, utilisant et vendant à d’autres l’objet revendiqué dans le brevet 191 parce qu’elle produit et vend le sofosbuvir au Canada sous le nom commercial Sovaldi, et ce, depuis le 6 janvier 2014.
[813] Même si j’ai conclu que le brevet 191 est invalide, je dois néanmoins examiner l’argument de contrefaçon avancé par Idenix aux fins d’un éventuel appel. Cet argument part du principe qu’Idenix a valablement prédit l’utilité des nucléosides 2’‑C‑Me/F et adéquatement divulgué la manière de les synthétiser. Partant de là, il incombe à la Cour de trancher la question entendue telle qu’elle est formulée dans l’ordonnance de disjonction modifiée de la protonotaire Tabib datée du 9 septembre 2014 (l’ordonnance de disjonction), à savoir :
[traduction]
1. Les questions suivantes intéressant la présente action doivent être instruites et tranchées séparément lors d’un procès qui aura lieu après celui prévu le 12 janvier 2015 (le « premier procès »), si nécessaire, dépendamment de l’issue du premier procès :
a. Quand, où et pendant combien de temps y a‑t‑il eu contrefaçon, et qui en est-il responsable?
b. Idenix a‑t‑elle droit à une injonction, à une mesure de réparation déclaratoire, à une remise et à une restitution des profits ou à des dommages‑intérêts relativement à des actes de contrefaçon?
c. Quelle est l’étendue de la contrefaçon, en tenant compte de l’application des exceptions prévues par la loi ou la common law?
d. Quel est le montant des dommages‑intérêts auxquels peut prétendre Idenix ou de dédommagement raisonnable de la contrefaçon et quel est le montant des profits réalisés du fait de la contrefaçon?
2. Par souci de clarté, les parties doivent débattre dans le premier procès de la question de savoir si le sofosbuvir et/ou Sovaldi et/ou le composé identifié au paragraphe 64A de la défense et demande reconventionnelle modifiées [le prétendu intermédiaire de fabrication] relèvent du brevet 191.
[814] La question à trancher en l’espèce est de savoir si le sofosbuvir et/ou Sovaldi et/ou le composé identifié au paragraphe 64A (le composé « intermédiaire ») de la défense et demande reconventionnelle modifiées relèvent du brevet 191.
B. Les observations des parties concernant la contrefaçon et conclusions
[815] Idenix présente trois observations par lesquelles elle prétend que Gilead a contrefait le brevet 191. La première contient une allégation de contrefaçon de l’[traduction] « intermédiaire de fabrication allégué », et est rédigée ainsi :
[traduction]
a) Le nucléoside 2’‑C‑Me/F de Gilead porteur d’un hydroxyle en positions 3’ et 5’ du cycle glucidique est visé, en tant qu’intermédiaire dans la préparation du sofosbuvir, par la revendication 3 du brevet 191 [la question du composé « intermédiaire »].
[816] Gilead conteste la compétence de la Cour pour entendre cette question eu égard à l’ordonnance de disjonction, et soutient que l’allégation de contrefaçon avancée par Idenix se rapporte à l’utilisation des composés revendiqués, plutôt qu’à la question de savoir si le composé intermédiaire relève du brevet 191. Gilead ne présente aucune autre observation concernant la contrefaçon par l’utilisation du nucléoside 2’‑C‑Me/F dans le sofosbuvir, sinon pour noter qu’il n’y a aucune contrefaçon étant donné que le brevet 191 est invalide.
[817] Les deux autres allégations de contrefaçon d’Idenix s’articulent autour de l’interprétation de la description du substituant R1 en position 5’ du cycle glucidique, laquelle est rédigée ainsi :
[traduction]
[…] phosphate; […] ou un groupe partant pharmaceutiquement acceptable qui, administré in vivo, est capable de fournir un composé où R1 […] est […] un phosphate.
[818] Les observations d’Idenix sur ce point sont les suivantes :
[traduction]
b) Le sofosbuvir SOVALDI de Gilead est visé par la revendication 2 du brevet 191, car il présente une entité phosphoramidate promédicamenteuse en position 5’, laquelle est un « phosphate » et un « groupe partant pharmaceutiquement acceptable qui, administré in vivo, est capable de fournir un composé où R1 est un phosphate » [utilisation du phosphoramidate].
c) Après l’administration du sofosbuvir SOVALDI de Gilead, le phosphoramidate promédicamenteux part, d’où l’obtention d’un composé monophosphate visé par la revendication 2 du brevet 191, lequel est phosphorylé in vivo par la suite, ce qui donne des composés diphosphate et triphosphate également visés par la revendication 2 du brevet 191 parce que R1 est un « phosphate » [métabolisation in vivo].
[819] Gilead répond à ces arguments par les observations suivantes :
[traduction]
a) le phosphate selon les revendications du brevet 191 est le PO4 (monophosphate);
(i) le phosphate selon les revendications du brevet 191 ne comprend pas le diphosphate, le triphosphate, le phosphate stabilisé ni le promédicament phosphate stabilisé;
(ii) le phosphate selon les revendications du brevet 191 ne comprend pas le phosphoramidate;
b) le phosphoramidate (groupe en position 5’ du sofosbuvir) ne répond pas à la définition de R1 dans les revendications du brevet 191 – ce n’est ni un phosphate ni un groupe partant pharmaceutiquement acceptable qui, administré in vivo, est capable de fournir un composé où R1 et/ou R2 sont indépendamment un H ou un phosphate;
c) les comprimés de SOVALDI ne sont pas visés par les revendications du brevet 191, puisque l’ingrédient médicinal, le sofosbuvir, n’est pas visé par les revendications;
d) les métabolites monophosphate, diphosphate et triphosphate du sofosbuvir ne sont pas visés par les revendications du brevet 191, ce brevet n’englobant pas les métabolites, et le terme « phosphate » dans les revendications du brevet 191 ne comprenant ni les diphosphates ni les triphosphates;
e) l’utilisation du PSI‑6206 dans la fabrication du sofosbuvir n’est pas visée par les revendications du brevet 191, ce brevet ne visant pas la fabrication d’intermédiaires.
[820] Dans l’analyse qui suit, j’examine d’abord l’observation d’Idenix selon laquelle le composé intermédiaire de Gilead relève du brevet 191. J’estime que c’est le cas, compte tenu de l’aveu tacite de Gilead selon lequel les structures des composés sont identiques.
[821] Je considérerai ci‑après la question d’interprétation du terme « phosphate », et je conclus qu’il englobe les métabolites monophosphate, diphosphate et triphosphate du sofosbuvir. Je conclus également que le phosphoramidate est un groupe partant pharmaceutiquement acceptable, ce terme servant à décrire le substituant R1 en position 5’ du cycle glucidique.
C. Le composé intermédiaire identifié au paragraphe 64A de la défense et demande reconventionnelle
[822] L’observation privilégiée par Idenix est que le composé intermédiaire servant à la fabrication du sofosbuvir et de Sovaldi est visé par le brevet 191. Gilead fait valoir que la question est de savoir si l’action de fabriquer, vendre ou utiliser le sofosbuvir ou ses métabolites, Sovaldi ou l’intermédiaire de fabrication constitue une contrefaçon. Elle prétend que ces questions ont toutes été disjointes pour être tranchées à une date ultérieure. La seule question dont la Cour est saisie concerne l’interprétation des revendications : le sofosbuvir, Sovaldi ou l’intermédiaire de fabrication relèvent‑ils des revendications du brevet 191?
[823] Je conviens qu’Idenix a plaidé cette question en fonction de la contrefaçon par utilisation. Par exemple, elle cite des décisions invoquant la « doctrine Saccharin » issue des arrêts Saccharin Corporation Ltd v Anglo‑Continental Chemical Works Ltd (1900), 17 RPC 307 (Div ch Angl) et Wilderman v Berk (1925), 42 RPC 79 (Div ch Angl), ainsi que d’autres affaires allant dans le même sens et qui établissent que l’importation et la vente d’un produit fabriqué à l’étranger à l’aide d’un procédé ou d’un intermédiaire breveté constituent une « utilisation » (et donc une contrefaçon). Je ne pense pas que ces arguments soient pertinents quant à la question telle qu’elle a été formulée par les parties dans l’ordonnance de disjonction.
[824] Cependant, Idenix inclut des observations suivant lesquelles le composé identifié au paragraphe 64A de la défense et demande reconventionnelle modifiées (l’intermédiaire de fabrication allégué) relève du brevet 191.
[825] L’utilisation reconnue par Gilead du composé revendiqué va dans le sens de l’article de Sofia publié par Pharmasset. Dans cet article, le groupe phosphoramidate est ajouté à l’analogue du nucléoside uridine (composé 5) de sorte que le nucléoside est utilisé comme intermédiaire dans la fabrication du sofosbuvir par Gilead. L’utilisation de l’intermédiaire visé par la revendication 3 peut être illustrée ainsi (à la page 7204) :
[826] Idenix signale que Gilead a admis que la structure des composés décrits au paragraphe 64A de la défense et demande reconventionnelle, reproduite ci‑après à droite, est la même que celle du composé 5 du schéma précédent. Je conclus donc qu’Idenix a raison de dire que l’intermédiaire de fabrication relève des revendications du brevet 191.
[827] Le groupe phosphoramidate est ajouté à l’analogue du nucléoside uridine de sorte que le nucléoside sert d’intermédiaire dans la fabrication du sofosbuvir par Gilead. Que le composé soit étiqueté comme servant d’intermédiaire ne change en rien ce qui est admis comme étant sa nature ou sa structure. Gilead convient qu’il se présente sous la forme présentée ci‑dessous, à gauche, qui elle est la même que celle de la revendication 3 du brevet 191, au milieu, et qui ressemble à celle de la revendication 15 du brevet 657, à droite, sauf pour ce qui est de la base.
[828] Gilead soutient que le brevet 191 vise seulement les nucléosides ou un nucléotide (avec un monophosphate en position 5’ du cycle glucidique). Le composé intermédiaire utilisé par Gilead est un nucléoside et il est nettement visé par le brevet 191 comme étant le composé nucléosidique de base visé par la revendication 3 et responsable de l’activité antivirale de l’invention revendiquée. J’accepte le témoignage de M. Damha selon lequel la personne versée dans l’art aurait su que des analogues nucléosidiques en général pouvaient servir à la fabrication de promédicaments nucléosidiques ou nucléotidiques.
[829] Je rejette également l’argument de Gilead selon lequel l’utilisation du nucléoside dans la fabrication du sofosbuvir n’est pas couverte par les revendications du brevet 191, celui‑ci ne visant pas la fabrication d’intermédiaires. En admettant ce raisonnement, l’utilisation indirecte de l’objet des revendications ne serait plus du tout envisagée ou couverte par le brevet. Celui‑ci n’a pas à viser toutes les utilisations imaginables des revendications. Il serait du domaine des connaissances générales courantes que ces nucléosides doivent servir d’intermédiaires dans la fabrication du médicament, sans quoi ils ne rempliraient pas leur fonction.
[830] Je conclus que le nucléoside 2’‑C‑Me/F de Gilead porteur d’un hydroxyle aux positions 3’ et 5’ du cycle glucidique et identifié au paragraphe 64A de la défense et demande reconventionnelle comme intermédiaire dans la préparation du sofosbuvir est visé par la revendication 3 du brevet 191.
D. Sofosbuvir SOVALDI – phosphate et groupe partant pharmaceutiquement acceptable
1) Le lecteur de choix versé dans l’art
[831] L’interprétation du terme « phosphate » et de l’expression [traduction] « groupe partant pharmaceutiquement acceptable qui, administré in vivo, est capable de fournir un composé où R1 est […] un phosphate » est largement déterminante dans les deux dernières questions convenues par les parties pour la requête en contrefaçon d’Idenix.
[832] Comme les termes en cause sont de nature technique, il est convenu que la Cour doit s’appuyer sur les opinions d’experts pour décider de l’interprétation à adopter dans son analyse des revendications.
[833] Comme on pouvait s’y attendre, les experts des parties ont fourni des opinions contradictoires. À mon avis, cela tient largement aux différences entre leurs domaines d’expertise, dont témoignent les attributs qu’ils prêtent au lecteur versé dans l’art et qu’ils demandent instamment à la Cour d’adopter.
[834] Pour Gilead, la question concerne les promédicaments; elle soutient qu’une personne versée dans le domaine des sciences pharmaceutiques et des promédicaments, comme M. Krise, qui est extrêmement qualifié pour s’exprimer sur ces questions, doit être écoutée. Inversement, MM. Damha, Barrett et Lamarre décrivent le chimiste versé dans l’art comme un membre de l’équipe de découverte des médicaments chargée d’inventer de nouveaux composés. M. Wnuk, qui fait partie de cette équipe, estime toutefois qu’il faudrait se fier à quelqu’un ayant de l’expérience dans les sciences pharmaceutiques et les promédicaments, comme M. Krise.
[835] Les experts d’Idenix adoptent le point de vue des chimistes versés dans l’art chargés des découvertes qui, s’étant acquittés de leur tâche, considèrent les promédicaments comme une question secondaire à aborder en termes très généraux, comme dans les brevets 191 et 657. Comme il est admis que le choix du promédicament à associer au composé antiviral représente un aspect du développement futur de l’invention, c’est là un élément sur lequel d’autres experts auront à travailler longtemps après le parachèvement de la conception du composé antiviral.
[836] Par contre, M. Krise se penche sur le métabolisme du promédicament, plus particulièrement sur la façon dont les groupes partants se détachent du promédicament phosphoramidate. Son opinion se porte seulement sur le libellé du substituant R1 de la revendication 1. Ses considérations contextuelles se limitent à celles qui concernent le métabolisme des promédicaments.
[837] À mon avis, le ou les lecteurs de choix versés dans l’art doivent être le chimiste à qui le brevet 191 s’adresse tout particulièrement. C’est là l’opinion de M. Barrett, qui est conforme à mon sens à son expérience en ces matières, et c’est la plus raisonnable puisqu’il n’est pas très logique de se fier à des chimistes qui ne s’intéressent pas à l’art visé par l’invention.
[838] Eu égard à ce critère de préférence, je conclus sans peine que le brevet 191 s’adresse tout particulièrement aux personnes versées dans l’art ou la science de la découverte de nouveaux médicaments par opposition à ceux qui travaillent à la mise au point du médicament après son invention.
[839] Par conséquent, je conclus que M. Krise est le seul expert que j’exclurais de l’équipe de découverte des médicaments, et par là je n’entends pas remettre en cause son expertise dans la mise au point de nouveaux promédicaments. Mais ces substances sont un objet secondaire dans le brevet 191. La critique de Gilead concernant les [traduction] « quelques pages » consacrées aux promédicaments confirme d’ailleurs que le brevet ne s’adressait pas au lecteur versé dans l’art ayant de l’expertise en cette matière.
[840] Je ne peux imaginer que M. Krise ait tiré beaucoup de renseignements d’intérêt pour son expertise d’un brevet qui divulguait un nucléoside brut au stade initial de son invention. Le lecteur versé dans l’art reconnaîtrait que ce brevet ne peut livrer de renseignements utiles sur des promédicaments à ce stade précoce d’une découverte de départ avec tout le travail de développement qui doit suivre, et notamment l’élaboration d’une stratégie appropriée en matière de promédicament. Je pense en fait que le lecteur versé dans l’art pharmaceutique serait du même avis que les personnes versées en découverte de médicaments ou dans d’autres domaines de développement pharmaceutique : elles ne s’attendraient qu’aux références les plus générales à l’égard des promédicaments sans aucune intention de limiter ni de préciser les candidats à choisir éventuellement dans l’avenir. Ces remarques trouvent un écho dans le brevet 657 de Gilead, qui présente de même des références très générales aux promédicaments, citant divers articles sans vraiment entrer dans les détails. Comme le brevet 191, il fait seulement mention en passant du phosphoramidate comme ayant été relevé dans les publications.
[841] M. Wnuk a inclus un pharmacologue dans son équipe versée dans l’art lorsqu’il a décrit la personne versée dans l’art. Mon opinion est que cet ajout à l’équipe de découverte de médicaments s’accorde tout à fait bien avec la décision prise par Gilead de faire appel à un pharmacologue comme expert pour les questions de contrefaçon. Je préfère la conclusion de M. Barrett qui va quelque peu à l’encontre de l’avis de M. Wnuk selon qui le pharmacologue aurait une expertise dans les [traduction] « aspects de la découverte de médicaments qui concernent la délivrance et le métabolisme des médicaments » et [traduction] « le chimiste médicinal et le virologue auraient une expertise collective dans ce domaine ». J’ajoute que M. Wnuk a eu la prudence de lier le pharmacologue à une certaine forme de « découverte de médicaments ». Dans la mesure où il peut y avoir une découverte de promédicaments liée à la présente invention, aucun élément semblable ne me semble évident.
[842] L’optique du chimiste spécialisé dans la découverte de médicaments cadre avec les descriptions limitées des brevets 191 et 657 sur les promédicaments. Les aspects essentiels de l’invention s’articulent autour de la découverte et de la mise à l’essai des nouveaux composés. Aucune intention d’identifier ou de limiter les promédicaments qui pourraient éventuellement être appliqués au nucléoside n’est décrite, sauf pour ce qui est d’indiquer que ceux qui seraient choisis pourraient entrer dans la cellule avec une entité monophosphate en position R1, prêts à entreprendre leur voyage pour détruire un virus après avoir été métabolisés en nucléoside triphosphate.
2) Le phosphate
[843] Il semble que les parties conviennent que le terme « phosphate » n’englobe pas un groupe partant pharmaceutiquement acceptable, ce sur quoi M. Krise a présenté bon nombre d’éléments de preuve. Le libellé de la section doit exclure une définition de phosphate qui engloberait un groupe partant pharmaceutiquement acceptable, puisqu’un phosphate est ce qui, in vivo, demeure après que le groupe partant quitte le promédicament pour fournir un phosphate. Le contexte de la description des substituants séparés par « ou » étaye également la conclusion selon laquelle le terme « phosphate » et l’expression « groupe partant pharmaceutiquement acceptable » sont indépendants.
[844] Ainsi, le débat sur l’interprétation de « phosphate » porte sur la question de savoir s’il s’agit d’un monophosphate comme Gilead le prétend ou s’il peut aussi s’agir d’un di‑ ou d’un triphosphate. Je conviens avec Gilead que, normalement, il y aurait une limite interprétative de l’emploi du terme phosphate. Employé deux fois dans la même définition, le terme devrait avoir le même sens, qu’il soit dans un médicament ou après, in vivo, ce qui laisse croire à l’existence de limites quant à sa définition. Je conviens également que le terme est ambigu dans la mesure où il y a beaucoup de confusion dans les différentes mentions des phosphates dans le mémoire descriptif et les différentes expressions en tant que monophosphate, ou les trois formes, lesquelles sont employées de façon interchangeable et sans distinction.
[845] Cela dit, je suis persuadé que le chimiste versé dans l’art aurait compris que, in vivo, le monophosphate du nucléoside doit être métabolisé par phosphorylation en diphosphate puis en triphosphate pour que le médicament ait une activité antivirale. Je conviens donc avec MM. Barrett et Damha que l’interprétation de phosphate offerte par Gilead n’aurait aucun sens pour le chimiste ou le virologue versé dans l’art si l’on se limitait à sa forme monophosphate. Cela serait contraire aux connaissances générales courantes sur la façon dont le composé nucléosidique doit produire son effet. Je conclus donc que « phosphate » comprend diphosphate et triphosphate dans la description du substituant R1.
[846] C’est la raison pour laquelle je ne peux pas accepter la thèse de Gilead selon laquelle les métabolites monophosphate, diphosphate et triphosphate du sofosbuvir ne sont pas visés par les revendications du brevet 191, étant donné que celui‑ci n’engloberait pas les métabolites. Le chimiste versé dans l’art comprendrait que ce qui reste et est décrit comme un « phosphate » après le départ du groupe partant est un monophosphate qui est métabolisé en diphosphate et en triphosphate pour être incorporé dans le processus de réplication du virus. Il est aussi possible que soit fabriqué un jour un analogue triphosphate sous forme de promédicament. Je ne vois pas pourquoi le brevet ne pourrait pas être élargi pour protéger cette forme de nucléotide.
[847] En revanche, je ne partage pas l’avis d’Idenix selon qui la personne versée dans l’art comprendrait qu’un phosphoramidate, bien qu’il contienne un phosphate, est lui‑même un « phosphate » selon la définition du terme, particulièrement dans le contexte de la description du substituant R1. J’accepte le témoignage de M. Krise selon lequel le terme phosphoramidate désigne une classe de promédicaments utilisés dans un but différent, essentiellement celui d’éliminer les obstacles qui limitent l’utilité thérapeutique du médicament et, plus particulièrement en l’espèce, les obstacles liés à la délivrance du nucléotide sous sa forme triphosphate à son site d’action. Les termes « phosphoramidate » et « phosphate » ne sont pas interchangeables. Ajoutons que le lecteur versé dans l’art qui considérerait la distinction entre un phosphate et un groupe partant pharmaceutiquement acceptable comprendrait que la définition du dernier doit s’appliquer aux formes promédicamenteuses de la molécule, qui normalement se forment en position 5’ du cycle glucidique, ce qui le distingue d’un phosphate.
3) Le groupe partant
[848] Par « groupe partant » dans ce contexte, on entend [traduction] « un groupe partant pharmaceutiquement acceptable qui, administré in vivo, est capable de fournir un composé où R1 est […] un phosphate ».
[849] Cinq experts ont fourni des avis sur la signification adéquate à donner à l’expression « groupe partant pharmaceutiquement acceptable », soit MM. Wnuk et Krise pour le compte de Gilead et MM. Damha, Barrett et Lamarre pour Idenix. M. Krise et M. Damha étaient les témoins principaux ayant étayé leurs avis par les explications les plus exhaustives.
a) M. Wnuk
[850] Dans son premier rapport, M. Wnuk reconnaît que la plus grande partie de la discussion sur les sels et les promédicaments dans le brevet 191 [traduction] « est hors de [s]on domaine de compétence ». De même, interrogé sur la façon de produire un promédicament nucléosidique, il a reconnu qu’il n’était [traduction] « pas [vraiment] un expert dans ce domaine d’étude ». Il avait néanmoins le sentiment que son expertise en chimie lui permettait de se prononcer sur le sens à donner à « groupe partant ». Il a affirmé que, dans le contexte du brevet 191, qui est manifestement le domaine des sels ou des promédicaments, il estimait qu’un « groupe partant » était un groupe sur un nucléoside qui, lorsque ce nucléoside est administré in vivo, est totalement clivé et est ensuite remplacé par un autre atome ou groupe d’atomes. Son rapport donne des exemples de groupes partants ainsi clivés. Dans un de ces exemples, deux entités distinctes sont clivées d’un composé, apparemment en une seule étape, ce qui semble quelque peu incompatible avec les vues qu’il exprime.
[851] Il était aussi d’avis que l’expression « pharmaceutiquement acceptable » n’a aucun sens généralement admis en chimie et qu’elle est ambiguë. La Cour fait cependant observer que le brevet 657 regorge de ce terme et qu’on le trouve également dans tout le brevet 191. M. Wnuk cite à l’appui de son opinion un expert dans Fox & Whitesell, Organic Chemistry, 2e édition, 1995. Cet ouvrage définit un groupe partant comme [traduction] « un groupe déplacé d’un réactant dans une réaction de substitution ou d’élimination ». Cette définition ne nous dit cependant pas si la réaction doit se produire en une ou trois étapes, ou si un groupe partant est formé d’un seul composé ou de plusieurs, ce qui permettrait de faire la différence entre son exemple des deux entités clivées en même temps et le cas où les entités seraient clivées l’une après l’autre.
[852] M. Wnuk complète l’opinion qu’il exprime dans le premier rapport en disant qu’un phosphoramidate n’est pas un [traduction] « groupe partant pharmaceutiquement acceptable […], puisqu’il n’est pas entièrement éliminé ou clivé au complet lorsque le sofosbuvir est administré aux patients in vivo ». Pour étayer cette opinion, il affirme que le chimiste versé dans l’art aurait compris que l’ester isopropylique, le cycle phényle et les constituants alanine du phosphoramidate sont des groupes partants distincts, chacun étant clivé à la suite de trois réactions distinctes in vivo.
b) M. Krise
[853] M. Krise offre le point de vue d’un chimiste pharmaceutique spécialisé dans tous les aspects de la mise au point et de l’application de promédicaments. Pour l’essentiel, il se dit d’avis que, parce que le sofosbuvir est métabolisé en un nucléotide 2’‑C‑Me/F en trois étapes au lieu d’une, ce n’est pas un véritable groupe partant, étant donné que, selon sa définition, un groupe partant doit quitter le nucléotide 2’-C-Me/F en une seule étape.
[854] M. Krise étaye son opinion d’une analyse détaillée de la métabolisation en trois étapes du sofosbuvir. La première étape est celle du départ de l’alcool isopropylique catalysé par la cathepsine A (CatA) humaine et la carboxylestérase 1 (CES1). La deuxième étape est celle de la cyclisation intramoléculaire où le groupe partant est un phénol. À la troisième étape, le groupe partant est l’acide aminé alanine qui est catalysé par une enzyme (Hint1), ce qui laisse le composé PSI‑6206‑MP à l’intérieur des cellules hépatiques infectées. Cette explication est décrite à la figure 6 de son rapport intitulé Metabolism of Sofosbuvir (Métabolisme du sofosbuvir) :
[855] Le composé PSI‑6206‑MP dans la partie inférieure gauche de la figure 6 est le même nucléotide 2’‑C‑Me/F avec un monophosphate en position 5’ du cycle glucidique que celui que décrit le brevet 191 après métabolisation par clivage du groupe partant. Comme M. Krise le conclut à juste titre, ce composé [traduction] « est effectivement piégé dans les cellules hépatiques et ensuite phosphorylé pour donner le PSI‑6206‑TP (le métabolite triphosphate), lequel a une activité antivirale ».
[856] M. Krise est à l’aise avec l’expression « pharmaceutiquement acceptable », mais déclare qu’un groupe partant est [traduction] « un groupe qui est entièrement clivé dans l’organisme pour donner le composé mère ». Il développe ainsi sa pensée :
[traduction]
Si le groupe installé en R1 est un « groupe partant pharmaceutiquement acceptable », il doit partir en entier et produire un nucléoside avec un groupe hydroxyle non conjugué en position 5’ (ce qui signifie que rien n’est lié au groupe hydroxyle en position 5’).
[857] Il conclut donc que le brevet 191 ne peut concerner un promédicament phosphoramidate, puisqu’il décrit un groupe partant clivé en une seule étape.
[858] Il fait également observer que, d’après ce qu’il savait le 8 janvier 2004, des stratégies faisant appel au phosphoramidate en tant que promédicament avaient été envisagées dans les publications comme méthode pour délivrer des nucléotides analogues, mais aucun composé faisant appel à cette stratégie n’avait été mis sur le marché. À sa connaissance, le sofosbuvir était le premier promédicament phosphoramidate sûr et efficace à être homologué pour la vente aux États‑Unis pour le traitement des infections virales.
[859] M. Krise n’étaye pas l’opinion qu’il exprime en s’appuyant sur des documents pharmaceutiques ou autre traitant de promédicaments ou de chimie biologique. Que son opinion ne soit pas étayée préoccupe la Cour. Si la distinction qu’il établit entre une métabolisation en une étape et en plusieurs étapes des promédicaments relève des connaissances générales courantes, je me serais attendu à ce que les publications fassent le type de distinction que M. Krise prie la Cour de faire afin de limiter le possible monopole d’Idenix. J’aurais espéré des références à une nomenclature scientifique qui distingue les promédicaments en fonction du nombre d’étapes de leur métabolisation in vivo, selon une certaine classification ou une certaine nécessité expérimentale pratique ou scientifique, de manière à décrire la nette distinction qu’attribue M. Krise aux termes du brevet 191.
[860] Il tente plutôt d’étayer son avis par les termes employés dans le brevet 191. Je reproduis ici l’argument justificatif de M. Krise au paragraphe 91 de son rapport :
[traduction]
[91] Cette opinion se trouve renforcée lorsqu’on considère les autres groupes énumérés dans la revendication 1 comme substituants possibles aux positions R1 et R2. Je note en particulier que nombre des autres groupes énumérés comme substituants possibles, dont le phosphate, les acyles, les lipides, les acides aminés, etc., me semblent être des groupes pouvant être clivé du nucléoside mère. Par exemple, les phosphatases, qui sont omniprésentes dans le corps humain, sont connues pour catalyser le retrait des groupes phosphate des molécules. De même, les estérases sont présentes dans le corps humain et facilitent le retrait des acyles, etc. De même, la personne versée dans l’art aurait compris que l’utilisation de l’expression « groupe partant pharmaceutiquement acceptable » visait à inclure les entités clivables similaires qui n’étaient pas expressément énumérées dans la revendication.
[Non souligné dans l’original.]
[861] À mon sens, le raisonnement de M. Krise n’est pas suffisamment téléologique. Il semble que, si le mot pluriel « groupes » au lieu de « groupe » au singulier avait été employé, de sorte que la phrase dise [traduction] « groupes partants pharmaceutiquement acceptables », la définition d’Idenix aurait englobé un promédicament phosphoramidate qui est métabolisé par clivage en trois étapes. Ce type d’interprétation [traduction] « purement littérale et découlant du genre d’analyse terminologique méticuleuse à laquelle les avocats s’adonnent trop souvent par formation », est de celle que lord Diplock avait vivement conseillé d’éviter : Catnic. (Je note encore une fois que les parties n’ont présenté aucune observation concernant les caractéristiques non essentielles ou originales d’une invention, suivant le « principe de l’arrêt Catnic » tel qu’il a été approuvé par la Cour suprême dans les arrêts Free World et Whirlpool, et aucun ne s’applique à la présente analyse.)
[862] Je ne comprends pas non plus la pertinence du commentaire de M. Krise au sujet de l’absence de mention expresse des promédicaments phosphoramidate dans le brevet 191 ou de l’absence d’indication que les inventeurs envisageaient de les utiliser. Comme il le fait observer, les promédicaments phosphoramidate n’avaient apparemment pas été appliqués avec succès aux analogues nucléotidiques en 2004. Par ailleurs, le brevet 657 de Gilead ne faisait aucune mention expresse de ces mêmes promédicaments, la seule mention que je connaisse figurant dans une référence d’article, comme c’est le cas dans le brevet 191.
[863] Je n’accepte pas non plus la logique de M. Krise lorsqu’il conclut que son argument est renforcé du fait que bon nombre des autres groupes mentionnés comme substituants possibles dans le brevet 191 sont des promédicaments à groupes partants en une seule étape, attribuant du même coup cette interprétation au sens de « groupe partant » dans les revendications. Toute mention du descripteur indéfini « bon nombre » appliqué à un ensemble de circonstances suppose logiquement qu’il ne s’applique pas à toutes les circonstances; les autres circonstances sont différentes. La description dans le brevet 191 de la façon dont le groupe partant est métabolisé doit donc être interprétée comme s’appliquant à la fois aux processus à une étape et aux processus à plusieurs étapes dans le libellé des revendications.
[864] Qui plus est, si l’on devait accepter le raisonnement de M. Krise qui distingue les promédicaments selon le nombre de réactions de clivage nécessaires pour produire le nucléotide monophosphate, le monopole qu’accorde à Idenix le brevet 191 vaudrait pour certains promédicaments, mais pas pour d’autres. J’estime qu’il s’agit d’un résultat déraisonnable et inacceptable que la Cour ne peut considérer comme découlant d’un promédicament de l’invention.
[865] En conclusion, les interprétations de M. Krise ne sont nullement celles d’un esprit désireux de comprendre le sens des termes – et qui accorde nécessairement une attention soutenue à l’objet et à l’intention de l’auteur, de la manière la plus propre à assurer la réalisation des objets du brevet, tels qu’ils se révèlent normalement dans le contexte. Je conclus, à l’égard du contexte dont se sert M. Krise, qu’il repose sur son expertise personnelle de scientifique pharmaceutique et non de chimiste médical ou de membre de l’équipe de découverte des médicaments.
c) M. Lamarre
[866] Témoignant au nom d’Idenix, M. Lamarre s’est limité à la conclusion selon laquelle un groupe partant pharmaceutiquement acceptable engloberait un promédicament nucléotidique pouvant être métabolisé et phosphorylé pour produire le composé actif à l’intérieur de l’hôte. Il a affirmé que les promédicaments nucléotidiques phosphoramidates constituaient un exemple de groupe partant pharmaceutiquement acceptable qui était connu avant 2004.
d) M. Barrett
[867] M. Barrett a conclu que l’expression [traduction] « groupe partant pharmaceutiquement acceptable qui, administré in vivo, est capable de fournir un composé où R1 est un phosphate » englobait les promédicaments en R1 qui laissaient à cette position un phosphate après clivage in vivo de l’entité promédicamenteuse. Contrairement au rapport de M. Wnuk, il niait que cette expression était « ambiguë » dans le contexte du brevet 191. Il était plutôt d’avis qu’elle serait immédiatement reconnue comme décrivant un promédicament et que les promédicaments sont des molécules qui sont clivées in vivo pour produire la forme active du produit. La partie clivée de la molécule peut être désignée par le terme « groupe partant ».
[868] Il a déclaré que, pour produire un promédicament, on ajoute une entité à une molécule médicamenteuse pour en améliorer une caractéristique, habituellement l’absorption, la distribution, le métabolisme ou l’excrétion (ADME). L’entité est clivée dans l’organisme après administration. Outre cette description générale, il a fait remarquer que les promédicaments étaient nettement du domaine du chimiste médicinal en janvier 2004.
e) M. Damha
[869] Dans son rapport du 19 septembre 2014, M. Damha a reconnu [traduction] « ne pas être un spécialiste des promédicaments pour ce qui est de suivre le métabolisme et la clairance de ces composés ». Il a toutefois été reconnu comme un expert en promédicaments dans la mesure nécessaire pour leur conception. Il possédait l’expertise nécessaire pour décrire comment le chimiste versé dans la découverte de médicaments lirait et comprendrait l’information contenue dans le brevet. De même, le lecteur versé dans le volet synthèse de la découverte de médicaments aurait connu la raison fondamentale pour laquelle l’analogue nucléotidique devrait être transformé en promédicament nucléotidique.
[870] M. Damha a décrit dans son témoignage comment le chimiste versé dans la découverte de médicaments comprenait la nécessité et le rôle des promédicaments. Dans son témoignage à cet égard, il explique pourquoi le nucléoside doit être phosphorylé en un nucléotide en dehors de la cellule par adjonction d’un monophosphate en position 5’ du cycle glucidique et précise que cette adjonction réduit l’efficacité du médicament contre les virus en limitant son absorption dans la cellule, d’où la nécessité d’un promédicament.
[871] M. Damha aborde les aspects du brevet 191 où il est généralement question de promédicaments. Il souligne que, à la page 107 (lignes 12 à 18), les promédicaments pharmaceutiquement acceptables sont décrits comme des composés qui sont métabolisés dans l’hôte pour former un composé actif, et cette description s’accompagne de nombreux exemples. Plus précisément, il fait remarquer que ce brevet parle de l’administration d’un promédicament nucléotidique ou nucléosidique pour accroître l’activité, la biodisponibilité et la stabilité ou pour autrement modifier les propriétés du nucléoside, y compris augmenter son introduction dans la cellule (page 108, lignes 16 à 20). De plus, en ce qui concerne les promédicaments phosphoramidate, un grand nombre de promédicaments nucléotidiques ont été décrits dans la documentation spécialisée, notamment dans l’article « Minireview: nucleotide prodrugs » de Jones et Bischofberger (1995), Antiviral Research 27:1‑17, où ces auteurs décrivent un ensemble de promédicaments nucléotidiques qui ont été fabriqués pour la zidovudine (azidothymidine, AZT), dont le promédicament phosphoramidate formé entre l’AZT‑phosphate et l’ester méthylique de l’alanine. Ce promédicament est mentionné parmi d’autres dans l’article et est décrit ci‑après (la troisième structure à partir de la gauche est celle d’un phosphoramidate) :
[872] Dans son rapport du 7 novembre 2014 où il répond aux opinions de M. Wnuk, M. Damha critique celui‑ci pour avoir appliqué littéralement une définition chimique hors contexte et du point de vue du pur chimiste de synthèse en faisant fi du contexte biologique où ces termes sont employés dans les revendications du brevet 191. Je souscris à cette observation.
[873] Dans ce contexte, les expressions « pharmaceutiquement acceptable » et « administré in vivo » désignent toutes deux le processus biochimique par lequel le composé actif atteint sa cible biologique. Il était bien connu qu’une entité promédicamenteuse finirait par quitter le composé, du moins en partie, une fois que celui‑ci entrerait dans l’environnement de sa cible biologique (McGuigan C. et al. (1992), Antiviral Research 17:311‑321). On doit considérer le sens de « groupe partant » de ce point de vue biochimique plutôt que selon la pure définition du chimiste comme celle que propose M. Wnuk; autrement dit, la personne versée dans l’art considérerait comme un promédicament un groupe partant « pharmaceutiquement acceptable » qui, administré in vivo, est capable de fournir un composé où R1 et/ou R2 sont indépendamment un H ou un « phosphate ».
[874] M. Damha a également fait observer que, selon une approche téléologique, l’expression « groupe partant » ne signifie pas nécessairement que le promédicament doive partir en une seule étape, une telle assertion étant incompatible avec le mode de fonctionnement connu des promédicaments. M. Damha affirme plutôt que, d’un point de vue téléologique, ce qui importe dans un système biologique, c’est que le promédicament exerce sa fonction, puis soit retiré du nucléoside ou du nucléotide. Qu’il parte en un tout ou par parties ne fait aucune différence. Il signale que cette question est traitée dans les articles de synthèse et autres références portant sur les promédicaments cités aux pages 108 à 112 du brevet 191.
[875] En conclusion, j’accepte l’opinion de MM. Damha et Barrett, et la retenue de M. Lamarre, qui refuse de se prononcer, quant au fait que l’expression « groupe partant » aurait dû être interprétée comme englobant toutes les formes de métabolisation des promédicaments, pourvu que ces formes demeurent pharmaceutiquement acceptables et produisent in vivo un nucléoside ou un nucléotide monophosphate en vue d’une métabolisation ultérieure : autrement dit, un promédicament approprié qui joue dûment son rôle de promédicament, et ce, sans que sa composition ne soit précisée ou limitée. Par conséquent, un groupe partant peut être un promédicament phosphoramidate, y compris dans son état de produit fabriqué tel que le sofosbuvir et dans les comprimés de Sovaldi, et il est visé par le brevet 191.
[876] En conclusion, le sofosbuvir et Sovaldi, y compris leurs formes métabolisées, et le composé identifié au paragraphe 64A de la défense et demande reconventionnelle modifiées (l’intermédiaire de fabrication) sont visés par le brevet 191.
XII. La demande reconventionnelle – Article 53 – Fausse déclaration volontaire de l’inventeur
A. Introduction et principes
[877] À titre très subsidiaire, Idenix fait valoir que le brevet 657 est invalide selon l’article 53 de la Loi sur les brevets parce qu’il omet délibérément de nommer M. Lieven Stuyver comme inventeur, une omission qu’Idenix qualifie de fausse déclaration volontaire faite pour induire en erreur et non faite de bonne foi.
[878] L’article 53 de la Loi sur les brevets, LRC 1985, c P‑4, dispose ce qui suit :
|
53(1) Le brevet est nul si la pétition du demandeur, relative à ce brevet, contient quelque allégation importante qui n’est pas conforme à la vérité, ou si le mémoire descriptif et les dessins contiennent plus ou moins qu’il n’est nécessaire pour démontrer ce qu’ils sont censés démontrer, et si l’omission ou l’addition est volontairement faite pour induire en erreur.
|
53(1) A patent is void if any material allegation in the petition of the applicant in respect of the patent is untrue, or if the specification and drawings contain more or less than is necessary for obtaining the end for which they purport to be made, and the omission or addition is wilfully made for the purpose of misleading. |
|
(2) S’il apparaît au tribunal que pareille omission ou addition est le résultat d’une erreur involontaire, et s’il est prouvé que le breveté a droit au reste de son brevet, le tribunal rend jugement selon les faits et statue sur les frais. Le brevet est réputé valide quant à la partie de l’invention décrite à laquelle le breveté est reconnu avoir droit. |
(2) Where it appears to a court that the omission or addition referred to in subsection (1) was an involuntary error and it is proved that the patentee is entitled to the remainder of his patent, the court shall render a judgment in accordance with the facts, and shall determine the costs, and the patent shall be held valid for that part of the invention described to which the patentee is so found to be entitled.
|
[879] L’article 53 évoque la notion de fraude (Eli Lilly Canada Inc c Apotex Inc, 2008 CF 142, au paragraphe 62). Pour que son allégation aboutisse, Idenix doit prouver :
a) qu’une fausse allégation a été faite (c.‑à‑d. que M. Stuyver était un inventeur et devait être ainsi désigné dans le brevet 657 au Canada);
b) que le défaut de le nommer comme inventeur était une fausse allégation « importante »;
c) que cette fausse allégation a été « volontairement faite pour induire en erreur » (671905 Alberta Inc c Q’Max Solutions Inc (2003), 27 CPR (4th) 385, à la page 400 (CAF)).
[880] Il reste à déterminer ce qui constitue une allégation importante, ce que j’examinerai ci‑après.
B. Le défaut de nommer M. Stuyver comme inventeur constitue‑t‑il une fausse allégation dans le brevet 657?
1) La copaternité de l’invention
[881] Pour déterminer qui est l’inventeur, la Cour doit découvrir l’auteur de l’idée originale. Comme je l’ai déjà souligné, les parties semblent avoir soigneusement évité la question de l’idée ou des étapes originales dans l’un ou l’autre des brevets. Dans la présente affaire, il semble que l’idée originale soit présumée être la conception du composé 2’‑C‑Me/F comme antiviral. Aucune partie ne veut aborder la question de savoir si la synthèse du composé 2’‑C‑Me/F supposait ou non une étape inventive. La question formulée par les parties est donc de savoir qui est ou qui sont les personnes ayant conçu le nucléoside 2’‑C‑Me/F en tant qu’antiviral. Il est entendu que les essais qu’il a effectués sur les produits de l’invention ne confèrent pas à M. Stuyver le titre d’inventeur. La Cour suprême a énoncé ce principe dans l’arrêt Wellcome/AZT, aux paragraphes 96 et 97 :
L’expression « paternité de l’invention » n’est pas définie dans la Loi, et sa définition doit, par conséquent, être inférée de divers articles. Par exemple, la définition du mot « invention », à l’art. 2, nous permet d’inférer que l’inventeur est la personne ou les personnes qui ont conçu la réalisation, le procédé, la machine, fabrication ou composition de matières, ainsi que tout perfectionnement de l’un d’eux, « présentant le caractère de la nouveauté et de l’utilité ». Par conséquent, la question qu’il faut se poser en définitive est la suivante : Qui est l’auteur de l’idée originale?
Aux termes du par. 34(1), il faut à tout le moins qu’au moment du dépôt de la demande de brevet, le mémoire descriptif « décri[ve] d’une façon exacte et complète l’invention […] qui permett[e] à toute personne versée dans l’art ou la science dont relève l’invention […] [d’]utiliser l’objet de l’invention ». Il ne suffit donc pas d’avoir une bonne idée (ou, pour reprendre l’expression utilisée dans l’arrêt Christiani, précité, p. 454, [traduction] « de dire qu’une idée nous est venue à l’esprit »); cette idée lumineuse doit prendre « une forme définie et pratique » (ibid.). Il va sans dire que, dans l’intervalle qui sépare la conception et la brevetabilité, l’inventeur peut avoir recours aux services d’autres personnes qui peuvent être très compétentes, mais ces autres personnes ne seront des coïnventeurs que si elles ont participé à la conception de l’invention plutôt qu’à sa vérification. Comme le juge Jenkins le fait remarquer dans l’affaire May & Baker Ltd. c. Ciba Ltd. (1948), 65 R.P.C. 255 (Ch. D.), p. 281, la [traduction] « découverte des qualités utiles », que doit avoir une invention, [traduction] « doit être faite par l’inventeur, par opposition à la simple vérification par ce dernier de prédictions antérieures ».
[Non souligné dans l’original.]
[882] Idenix reconnaît qu’il peut y avoir plusieurs inventeurs, mais fait valoir que chacun d’eux doit apporter une contribution à l’idée originale : Wellcome/AZT, au paragraphe 99, citant Gerrard Wire Tying Machines Co c Cary Manufacturing Co, [1926] C. de l’É. 170) :
[traduction]
Un brevet délivré à des coïnventeurs n’est pas non plus invalidé par le fait que l’un d’eux seulement a perçu au départ la forme rudimentaire des éléments et la possibilité de les adapter pour atteindre le résultat souhaité. En fait, la conception du dispositif dans son entier peut être l’œuvre d’un seul, mais si l’autre fait des suggestions valables sur le plan pratique qui aident à réaliser l’idée principale ou à la mettre à exécution, ou s’il apporte à l’ensemble de l’invention une contribution indépendante qui aide à réaliser le tout, il est un coïnventeur même si sa contribution est peu importante.
[883] Idenix soutient que M. Stuyver a conçu le composé 2’‑C‑Me/F en tant qu’antiviral pour lutter contre le VHC. Elle n’a cependant pas allégué que Jeremy Clark est un inventeur. Elle déclare dans ses observations écrites que [traduction] « ce n’est pas parce que Jeremy Clark a été le premier chez Pharmasset à synthétiser un composé revendiqué qu’il s’ensuit nécessairement qu’il est l’inventeur ». Toutefois, je n’accepte pas ce sous‑entendu comme un argument ou une observation voulant que Jeremy Clark ne soit pas un inventeur : cette question n’a jamais été soumise à la Cour.
[884] Par conséquent, aux fins qui nous occupent, si je conclus que M. Stuyver a contribué à l’idée de Jeremy Clark en réalisant l’invention, il sera un coïnventeur.
2) La déposition de M. Stuyver concernant sa contribution à l’invention du brevet 657
[885] M. Stuyver était vice‑président aux sciences biologiques chez Pharmasset. Il a dirigé l’équipe de biologistes responsables de la mise à l’essai des composés. Il a témoigné que l’idée de la formule 2’‑C‑Me/F lui avait été inspirée par ses travaux antérieurs avec des fluorures en position 2’ (bas) du cycle ribose, ainsi que par ses tâches de gestion d’une bibliothèque de documents scientifiques pour Pharmasset, où il a fait des recherches sur des composés ayant une activité antivirale. Il a aussi dit avoir été inspiré par la demande de brevet WO 02/18404 de Roche. Cette demande confirmait l’activité antivirale d’un des composés de Pharmasset contenant un fluor en position 2’ (bas) en instance de brevet. M. Stuyver soutient que M. Schinazi était fâché de le voir travailler sur des composés porteurs d’un fluor en position 2’ et mécontent qu’il ait découvert une molécule dotée d’une activité antivirale en position 2’ (bas).
[886] M. Stuyver allègue en outre avoir relevé l’omission du fluor en position 2’ (bas) dans la demande de brevet d’Idenix dont il a été question. Il déclare que le sujet a été abordé quelques fois au cours de l’été, mais M. Schinazi n’a jamais donné pour instruction de commencer à travailler sur la synthèse de ce composé. Comme ce type d’approche l’a un peu déçu, il s’est adressé à Jeremy Clark parce qu’il était du genre à [traduction] « commencer à travailler là‑dessus discrètement ». Il prétend que ses échanges avec M. Clark sont confirmés à la page 25 du carnet de laboratoire de ce dernier (pièce I‑23 du procès), datée du 6 décembre 2002 et signée par eux deux. La page est reproduite intégralement ci‑après.
[887] Cette page présente une note de la main de M. Stuyver où figure la mention [traduction] « composés candidats comme anti‑VHC ». Il affirme que cette mention renvoie aux trois structures de composés de cette page dont il a discuté avec Jeremy Clark, dont le composé 3, le nucléoside 2’‑C‑Me/F. Il y a aussi une mention de Jeremy Clark à la page du carnet : [traduction] « Plan rétrosynthétique pour l’idée de LS [Lieven Stuyver] ». M. Stuyver prétend qu’il s’agit du composé 3, c’est‑à‑dire du nucléoside cytidine 2’‑C‑Me/F avec la note en regard [traduction] « pour VHC ». Il allègue que c’est là la preuve de sa contribution à l’idée qui devait amener Jeremy Clark à synthétiser le nucléoside 2’‑C‑Me/F.
[888] La page du carnet de Jeremy Clark est d’une interprétation difficile, plus particulièrement la mention [traduction] « Plan rétrosynthétique pour l’idée de LS ». Il y a aussi dans la case de dessous le commentaire suivant : [traduction] « proposition de L. Stuyver le 12/6/02 où n = 1 ». Rien de cela n’a à voir avec le nucléoside 2’‑C‑Me/F. En ce qui concerne ce composé, ce qui ressort, c’est seulement que Jeremy Clark avait du mal à trouver un moyen de le synthétiser et que la solution n’était nettement pas à portée de main, à en croire ces dessins. M. Stuyver reconnaît qu’il ne se rappelait pas bien sa conversation avec M. Clark, et que son souvenir des événements est imprécis.
[889] Pharmasset avait en place des protocoles de consignation immédiate des idées potentiellement originales. Ces protocoles n’ont pas été respectés si M. Stuyver a réellement eu l’idée de synthétiser le nucléoside 2’‑C‑Me/F. Les pages de carnets devaient être signées par des témoins qui ne se considéraient pas comme des coïnventeurs. Par ailleurs, M. Stuyver a laissé entendre qu’il avait eu l’idée du composé au cours de l’été 2002, ce que n’attestent pas les documents.
[890] Même si je reconnais que cet élément de preuve révèle qu’il y a eu des discussions entre M. Stuyver et Jeremy Clark établissant qu’il avait proposé une idée, je ne pense pas que cela soit assez convaincant pour l’emporter sur l’autre élément de preuve d’après lequel M. Clark avait décidé de fabriquer le composé, probablement sur les instructions de M. Watanabe, parce qu’il estimait qu’Idenix avait omis l’analogue nucléosidique 2’‑C‑Me/F dans sa demande de brevet.
[891] En particulier, j’ai du mal à accepter la prétention de M. Stuyver lorsqu’il affirme qu’il est la personne à avoir découvert le « trou » dans le brevet d’Idenix, soit le fait qu’elle a négligé de revendiquer le nucléoside 2’‑C‑Me/F comme analogue possible du composé 2’‑C‑Me/OH. Cet élément de preuve paraît fortement coïncider avec sa déposition selon laquelle l’idée lui était venue indépendamment de son propre travail, et il avait visiblement dû approcher Jeremy Clark en secret, sans la permission de M. Schinazi. J’estime aussi que ce dernier témoignage n’a pas beaucoup de sens, sinon pour attaquer M. Schinazi, ce qui était la teneur générale de la déposition de M. Stuyver.
[892] Le plus important cependant, c’est que le témoignage de M. Stuyver selon lequel il aurait relevé l’omission concernant le composé d’Idenix est largement contredit par le témoignage de M. Patterson sur la façon dont a été choisi le nucléoside 2’‑C‑Me/F comme candidat pour la synthèse.
[893] Selon M. Patterson, M. Schinazi a annoncé aux chimistes que le nucléoside 2’‑C‑Me/OH d’Idenix dans son brevet était actif contre l’hépatite C, et il voulait qu’ils envisagent de synthétiser des analogues de ce nucléoside. M. Watanabe aurait présenté des analogues d’intérêt. M. Patterson a affirmé qu’aucun d’eux n’était particulièrement désireux de fabriquer des analogues, car ils étaient tous certains qu’Idenix avait couvert tous les analogues raisonnables.
[894] Ainsi qu’il est mentionné plus haut, tel était le cas, ainsi qu’en témoignent les notes de la rencontre de Maui en décembre 2001 où il a été décidé qu’Idenix essaierait de synthétiser un certain nombre d’analogues du nucléoside 2’‑C‑Me/OH avec de nouveaux substituants en position 2’ (bas). M. Patterson a en outre exprimé la conviction dans son témoignage que Jeremy Clark avait découvert l’omission des molécules 2’‑C‑Me/F dans le brevet d’Idenix. Cela avait causé tout un émoi chez Pharmasset, où l’on s’interrogeait sur la raison de cette omission, et on avait alors déployé des efforts pour fabriquer la molécule en question.
[895] Ce témoignage fait manifestement voir que l’idée que le nucléoside 2’‑C‑Me/F ait peut‑être une activité antivirale n’était pas originale, pas plus que l’idée d’en entreprendre la synthèse n’était celle de M. Clark ou de M. Stuyver. Ni l’une ni l’autre des parties n’avance cependant cet argument, ce qui ferait tourner le débat autour de la question de savoir si la synthèse du composé était l’idée originale ou l’étape inventive.
[896] M. Patterson a également déclaré que le remplacement de l’hydroxyle par le fluor était son premier choix en raison des similitudes de structure. Je crains cependant quelque peu que le recul ne joue un rôle dans cette opinion. Il s’agit toutefois d’un fondement différent du raisonnement de M. Stuyver, à qui l’idée aurait été insufflée par ses travaux antérieurs à la bibliothèque des brevets de Pharmasset et dans les essais de composés synthétisés par d’autres chimistes.
[897] Il s’est souvenu que Jeremy Clark était celui qui s’était exprimé le plus haut et le plus fort sur l’omission trouvée dans le brevet. Il avait donc pris l’initiative de tenter de synthétiser le composé. Il se souvient que Jeremy Clark avait voulu préparer le composé en synthétisant d’abord la partie glucidique de la molécule, puis en la couplant avec le nucléoside. Il a également déclaré qu’il lui avait fallu beaucoup de temps pour arriver à quelque chose, et il avait donc commencé à recevoir des conseils.
[898] M. Patterson avait une meilleure mémoire et s’est montré plus apte à rapporter les événements relatés par les divers témoins ayant déposé sur le sujet. Il était également indépendant, même s’il a été appelé par Idenix. Je préfère sa déposition à celle de M. Stuyver. Elle s’accorde aussi avec les vues partagées par MM. Stuyver et Otto selon lesquelles le nucléoside 2’‑C‑Me/F avait été choisi pour la synthèse parce qu’il était un analogue du composé antiviral 2’‑C‑Me/OH qui avait été omis dans le brevet d’Idenix.
[899] Elle concorde également avec l’idée d’un jeune chimiste chez Pharmasset qui s’est vu confier la synthèse du composé – ce que d’autres imaginaient qu’Idenix avait probablement tenté – comme une sorte de récompense pour avoir relevé l’omission dans le brevet.
[900] Je trouve aussi digne de mention le fait qu’Idenix n’ait pas demandé à M. Patterson s’il savait que M. Stuyver avait joué un rôle dans les événements ayant mené à la synthèse du nucléoside 2’‑C‑Me/F. Pharmasset était une petite organisation et il paraît probable que M. Patterson ait été au courant d’allégations contraires relatives à la découverte de cette omission dans le brevet. Il semble aussi laisser entendre que M. Watanabe aurait pu avoir proposé le composé comme un des analogues possibles.
[901] [EXPURGÉ]
[902] De même, après que M. Stuyver eut exprimé des préoccupations concernant la paternité de l’invention, [EXPURGÉ].
[903] Idenix soutient que Jeremy Clark aurait dû être appelé par Gilead. M. Otto a expliqué sa réticence à le faire. J’ai déjà mentionné que je n’étais pas disposé à présumer quoi que ce soit parce que Jeremy Clark n’a pas témoigné.
[904] Compte tenu de la preuve dont la Cour dispose, je ne suis pas convaincu qu’Idenix a démontré que M. Stuyver a probablement contribué à l’invention du nucléoside 2’‑C‑Me/F.
3) La suppression du nom de M. Stuyver à titre de coïnventeur sur la demande 657
[905] M. Stuyver figurait comme coïnventeur sur la demande de brevet provisoire 368 de Pharmasset, qui correspond à la demande de priorité pour la demande canadienne de Gilead. Avant de déposer la demande PCT ayant abouti au brevet 657, M. Stuyver a décidé de quitter Pharmasset pour retourner en Belgique. Idenix a d’abord soutenu que M. Schinazi, le fondateur et directeur général de Pharmasset, avait été mécontent du départ de M. Stuyver et qu’il avait fait retirer son nom comme inventeur sur la demande PCT. Cet argument n’a pas été maintenu dans les observations écrites finales et je le rejette, car il n’est absolument pas étayé par la preuve.
[906] Je juge raisonnable que M. Stuyver ait initialement été nommé dans la demande de brevet provisoire américain 368 parce qu’il avait supervisé les essais du PSI‑6130, et non parce qu’on aurait eu la perception qu’il avait eu l’idée du composé. Cette conclusion s’accorde avec la déclaration sommaire de M. Stuyver dans le passage ci‑dessus où il est question du rôle qu’il a joué en réalisant les essais du nucléoside 2’‑C‑Me/F.
[907] Des éléments de preuve établissent également que la décision concernant les personnes qui seraient nommées comme inventeurs du composé a été prise à la hâte afin de déposer la demande et de revenir ultérieurement sur la question de l’identité des inventeurs. (EXPURGÉ)
[908] Cependant, Idenix maintient son observation selon laquelle M. Stuyver a signé sous la contrainte la déclaration en vertu de laquelle il se retirait comme coïnventeur. M. Stuyver a affirmé que la déclaration est inexacte lorsqu’elle indique qu’il n’était pas un inventeur.
[909] Il a déclaré que M. Otto lui avait dit que, s’il ne signait pas la déclaration, [traduction] « ce serait absolument terrible pour la société et très mauvais pour [lui] ». Quant aux répercussions négatives sur M. Stuyver, il a déclaré : [traduction] « je n’avais pas le choix, je devais signer, sinon, d’après ce que j’ai compris, ils s’apprêtaient à me priver de mes options ».
[910] M. Otto nie avoir fait une telle menace. Bien qu’il ait eu des trous de mémoire pendant son témoignage, ce qui est compréhensible lorsqu’il s’agit de se souvenir d’événements vieux de presque dix ans, il s’est montré un témoin crédible. M. Otto et M. Stuyver étaient proches, ils partaient ensemble en vacances avec leurs épouses, notamment vers l’époque où la menace aurait été proférée. Il ne me paraît pas vraisemblable que M. Otto traite un vieil ami d’une manière si déloyale, alors que rien dans le dossier ne semble démontrer que Pharmasset n’essayait pas simplement de déterminer l’identité des inventeurs du nucléoside 2’‑C‑Me/F, ou que les options de M. Stuyver aient été menacées d’une manière ou d’une autre.
[911] Aucun des témoins n’a pu se souvenir des détails des discussions qu’ils avaient eues. Comme il incombait à M. Stuyver de prouver la contrainte, cela n’appuie pas sa position. [EXPURGÉ]
[912] [EXPURGÉ]
[913] [EXPURGÉ]
[914] De plus, j’estime que l’allégation de M. Stuyver selon laquelle M. Schinazi aurait supprimé son nom parce qu’il avait quitté Pharmasset, entache quelque peu son témoignage. Cela s’est produit après la synthèse du composé et la démonstration par M. Stuyver de sa puissance contre le VHC. M. Stuyver fonde cette allégation sur la preuve par ouï‑dire extrêmement faible d’un collègue anonyme. Celle‑ci est contredite par la preuve documentaire d’après laquelle il a quitté Pharmasset en bons termes pour des raisons personnelles, ses contributions à la société étant grandement appréciées et ses options d’achat d’actions tout à fait intactes.
[915] S’il n’avait pas encaissé tôt ses options d’achat d’actions, ses contributions auraient été généreusement rétribuées. Il a réclamé ensuite d’autres dédommagements, mais a essuyé un refus. Eu égard aux bénéfices phénoménaux que l’invention a procurés à Pharmasset et au fait que celle‑ci ait reconnu sa contribution à ces résultats, je ne crois pas que ce soit pure conjecture de l’imaginer un peu aigri à l’égard de tous ceux qui le privent selon lui de sa juste récompense, y compris M. Otto, même si rien ne le justifie.
[916] Il est malheureux qu’il n’ait pas profité de son travail dans la même mesure que d’autres collaborateurs chez Pharmasset, mais je conclus qu’il n’était pas un coïnventeur du composé et qu’il n’a pas signé sous la contrainte la déclaration par laquelle il a reconnu ce fait en 2005.
4) La « pétition du demandeur [contenant une] allégation importante » regardant la paternité de l’invention et l’autre interprétation du paragraphe 53(1)
a) L’importance
[917] Idenix soutient que le défaut de nommer M. Stuyver représentait une fausse allégation « importante » dans la pétition du demandeur à l’égard du brevet 657, au sens de l’article 53 de la Loi. Elle prétend que cette omission est importante pour le public, qui doit être en mesure de communiquer avec les inventeurs désignés pour discuter de l’invention et de possibles améliorations, ce qui peut aboutir à d’autres avancées dans l’art. Elle ajoute que la reconnaissance de l’identité des inventeurs par le Bureau canadien des brevets canadien favorise l’intégrité du Bureau du commissaire et du système canadien des brevets, ainsi que le respect des obligations internationales du Canada.
[918] Idenix cite l’arrêt rendu par la Cour d’appel dans l’affaire Corlac Inc c Weatherford Canada Inc, 2010 CF 602, modifié par 2011 CAF 228, aux paragraphes 123 et 124 (Corlac), et rappelle que les bénéfices pour les inventeurs, le public et le système canadien des brevets ne doivent pas être minimisés.
[919] Il me semble toutefois qu’une lecture impartiale de l’arrêt Corlac révèle que la Cour a largement minoré l’effet de l’omission inappropriée du nom d’un coïnventeur sur la détermination de l’importance aux fins du paragraphe 53(1).
[920] Le juge Michael Phelan, dans la décision rendue par la Cour fédérale dans Corlac, au paragraphe 337, a estimé que le nom d’un coïnventeur de l’objet du brevet en cause avait été indument omis. Il a néanmoins conclu que l’omission n’était pas importante, étant donné qu’à la période pertinente, le breveté avait acquis tous les droits et intérêts à l’égard du brevet, et qu’il l’aurait fait, que le coïnventeur ait été nommé ou pas.
[921] La Cour d’appel fédérale a confirmé le raisonnement du juge de première instance et expliqué aux paragraphes 123 à 125 le peu de gravité de l’omission du nom d’un coïnventeur.
[123] La troisième justification repose sur divers arguments de politique publique et sur des dispositions de la Loi portant sur l’identification des inventeurs, la nécessité de promouvoir l’intégrité du Bureau du commissaire et du système des brevets canadien, les obligations internationales du Canada et les bénéfices personnels auxquels les inventeurs ont droit à l’égard de leurs inventions. Quoiqu’il ne faille pas diminuer leur force, il est très douteux à mon avis que les arguments des appelantes soient déterminants pour interpréter l’importance dans le contexte du paragraphe 53(1). Je renverrai encore une fois à l’arrêt Q’Max dans lequel l’annulation absolue du brevet sur le fondement d’une déclaration inexacte de paternité d’invention a été considérée comme une « réparation draconienne ». Les arguments de politique des appelantes doivent être mis en balance avec ce résultat. Si la position des appelantes était correcte, elle donnerait lieu à une anomalie. En effet, d’autres inventeurs perdraient effectivement leurs intérêts dans le monopole de leur brevet plutôt que de pouvoir avoir accès à ce qu’il leur avait été antérieurement refusé.
[124] L’argument le plus fort des appelantes à cet égard est leur prétention selon laquelle la révélation exacte de l’identité des inventeurs procure un certain nombre de bénéfices au public. Les appelantes soutiennent que l’identification des inventeurs permet au public de joindre ces inventeurs pour discuter de l’invention et proposer des améliorations éventuelles, qui, à leur tour, contribuent au progrès de l’art. Elles soutiennent en outre que, aux termes du paragraphe 237(4) des Règles des Cours fédérales, DORS/98‑106 (les Règles des Cours fédérales), les parties à une action en contrefaçon de brevet ont le droit de soumettre les inventeurs à un interrogatoire à titre de cédants de leurs droits de brevet. Il est fait valoir que le défaut de révéler l’identité des inventeurs nuit au droit d’un défendeur de donner une réponse complète et de se défendre contre des allégations de contrefaçon dans de telles circonstances.
[125] Ces arguments, tout aussi intéressants qu’ils soient, sont loin d’être concluants. Les appelantes ne soutiennent pas que le public a un droit particulier de communiquer avec les inventeurs figurant au registre des brevets ou que les inventeurs sont de quelque façon obligés de répondre à des tentatives de communication. L’interrogatoire d’un inventeur en vertu du paragraphe 237(4) des Règles des Cours fédérales peut se révéler utile, mais il s’agit, non d’un interrogatoire préalable d’une partie, mais d’un interrogatoire antérieur au procès d’un témoin potentiel : Lido Industrial Products Ltd. c. Teledyne Industries Inc., (1978), [1979] 1 C.F. 310, paragraphe 11 (C.A.). Il demeure loisible aux parties au litige de recourir à l’article 238.
[Non souligné dans l’original.]
[922] Dans l’arrêt Apotex Inc c Wellcome Foundation Ltd (2000), 195 DLR (4th) 641, au paragraphe 48, la Cour d’appel fédérale se dit également d’avis que le défaut de nommer un coïnventeur ne constitue pas une fausse déclaration importante :
L’examen de la prétention d’A & N selon laquelle l’omission de nommer un coïnventeur est une assertion inexacte importante conduisant à l’invalidité fait ressortir l’illogisme de cette proposition. Si cette omission constituait une assertion inexacte importante, un véritable inventeur qui ne serait pas nommé dans un brevet serait privé de tout recours lui permettant de partager le monopole de son invention.
[Non souligné dans l’original.]
[923] Idenix n’a produit aucun élément de preuve établissant en quoi l’omission alléguée de nommer M. Stuyver a affecté les dispositions, la substance ou la titularité du brevet 657, ou la capacité du public d’utiliser l’invention. Au contraire, elle reconnaît que la désignation de M. Stuyver sur le brevet 657 n’aurait eu aucune incidence sur la titularité, et fait valoir ce qui suit :
[traduction]
En vertu de leurs contrats d’emploi avec Pharmasset, les droits de Jeremy Clark et de Lieven Stuyver à l’égard de l’invention qu’ils auraient réalisée ont été transférés à la même personne morale.
[924] On a laissé entendre au cours du contre‑interrogatoire de M. Otto, le dernier jour de l’instruction, que M. Stuyver était possiblement tenu de céder ses droits sur l’invention au gouvernement américain en raison de la subvention de recherche dont il avait bénéficié, et que cela pouvait avoir des répercussions importantes sur l’utilisation par le public du brevet 657 et s’avérer important quant aux droits liés à l’invention.
[925] Cette affirmation n’a pas été étayée par la preuve, et l’argument relatif à ce scénario n’a pas été défendu. Il contredit d’ailleurs l’admission d’Idenix et la preuve établissant que Pharmasset aurait détenu tous les droits pertinents même si M. Stuyver avait été nommé. J’écarterai cet élément de preuve qui ne regarde nullement la question de l’importance.
[926] Idenix prétend que la présente affaire est sans précédent en raison du caractère volontaire de l’omission. Elle avance que, si elle est en mesure de prouver que le nom de M. Stuyver a été omis « volontairement […] pour induire en erreur », l’exigence relative à l’importance serait alors automatiquement respectée. Elle renvoie aux observations du juge James O’Reilly dans la décision Merck & Co c Canada (Santé), 2010 CF 1042, 88 C.P.R. (4th) 98, au paragraphe 56 (Merck/dorzolamide), dans laquelle un argument similaire fondé sur le paragraphe 53(1) « aurait eu un poids considérable » si le juge n’avait pas conclu qu’il n’y avait pas eu de fausse allégation concernant la paternité de l’invention.
[927] Comme j’ai conclu qu’il n’y avait eu ni contrainte ni volonté de supprimer le nom de M. Stuyver comme inventeur dans la pétition, je n’ai pas à trancher cette question. Je souligne toutefois que Gilead conteste cette observation au motif qu’elle est contraire à la règle d’interprétation législative courante suivant laquelle les mots employés dans une loi sont censés remplir une fonction spécifique dans l’accomplissement de l’objectif législatif (Ruth Sullivan, Sullivan on the Construction of Statutes, 5e éd. (Markham, Lexis Nexis Canada Inc, 2008), à la page 210).
[928] Si la théorie d’Idenix était juste, il aurait été superflu d’utiliser le terme « importante » si la législature avait voulu que le critère de l’article 53 puisse être rempli en démontrant seulement qu’une fausse déclaration avait été faite volontairement pour induire en erreur. Ce raisonnement me paraît convaincant et il est d’ailleurs appuyé par une analyse analogue de la Cour suprême du Canada dans l’arrêt R c Kelly, [1992] 2 RCS 170, aux pages 187 et 188.
5) Conclusion
[929] Pour tous les motifs qui précèdent, je rejette l’allégation d’Idenix selon laquelle le brevet 657 est invalide aux termes du paragraphe 53(1).
XIII. CONCLUSIONS ET DÉPENS
[930] En conclusion, j’estime que les allégations de Gilead concernant l’invalidité du brevet 191 sont fondées. Je déclare le brevet 191 et chacune de ses revendications invalides, nuls et sans force exécutoire in rem réelle pour cause d’inutilité et d’insuffisance.
[931] Je rejette en outre la demande reconventionnelle d’Idenix dans son intégralité.
[932] Gilead aura droit à ses dépens dans l’action et la demande reconventionnelle, y compris les dépens se rapportant aux requêtes présentées avant et pendant l’instruction et à l’égard desquelles aucune ordonnance n’avait été rendue.
[933] Les parties fourniront à la Cour leurs observations concernant les dépens, qui devront être présentées conformément à un échéancier dont elles conviendront et qui sera fourni à la Cour dans les quatre semaines de la publication du présent jugement.
[934] Gilead déposera ses observations initiales, Idenix y répondra et Gilead répliquera à toute nouvelle question soulevée par Idenix dans ses observations, dans les délais prévus par l’échéancier.
JUGEMENT
LA COUR STATUE que :
1. Gilead a qualité pour intenter la présente action en vertu du paragraphe 60(1) de la Loi sur les brevets.
2. Le brevet 191 et chacune de ses revendications sont déclarés invalides, nuls et sans force exécutoire in rem réelle.
3. La demande reconventionnelle d’Idenix est rejetée.
4. Gilead a droit à ses dépens dans l’action et la demande reconventionnelle, qui sont payables par Idenix, lesquels dépens comprennent les dépens se rapportant aux requêtes présentées avant et pendant l’instruction et à l’égard desquelles aucune ordonnance relative aux dépens n’avait été rendue; tous ces dépens seront déterminés après le dépôt des observations des parties et l’audition des plaidoyers, s’il y a lieu et si la Cour l’ordonne.
« Peter Annis »
Juge
Traduction certifiée conforme
M.-C. Gervais
COUR FÉDÉRALE
AVOCATS INSCRITS AU DOSSIER
|
DOSSIER : |
T‑1156‑12
|
|
INTITULÉ : |
GILEAD SCIENCES, INC ET GILEAD SCIENCES CANADA, INC c IDENIX PHARMACEUTICALS, INC, UNIVERSITA DEGLI STUDI DI CAGLIARI, L’UNIVERSITÉ MONTPELLIER II ET LE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE ET UNIVERSITA DEGLI STUDI DI CAGLIARI, L’UNIVERSITÉ MONTPELLIER II ET LE CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE
|
|
LIEU DE L’AUDIENCE : |
Toronto (Ontario)
|
|
DATE DE L’AUDIENCE : |
LE 12 janvier 2015
|
|
VERSION PUBLIQUE DU JUGEMENT ET DES MOTIFS : |
LE JUGE ANNIS
|
|
DATE DU JUGEMENT ET DES MOTIFS : |
LE 2 NOVEMBRE 2015
|
COMPARUTIONS :
|
Jason Markwell, Jordana Sanft, Amy Grenon, Adam Haller
|
POUR LES demanderesseS
|
|
Patrick Smith, Alex Gloor,Viktor Haramina, Ivy Tsui, Melissa Binns, ChrisVanBarr
|
POUR LES DÉFENDEURS
|
AVOCATS INSCRITS AU DOSSIER :
|
Norton Rose Fulbright Canada, S.E.N.C.R.L., s.r.l. Avocats |
POUR LES demanderesseS
|
|
Gowling Lafleur Henderson S.E.N.C.R.L., s.r.l. Avocats |
pour les défendeurs |